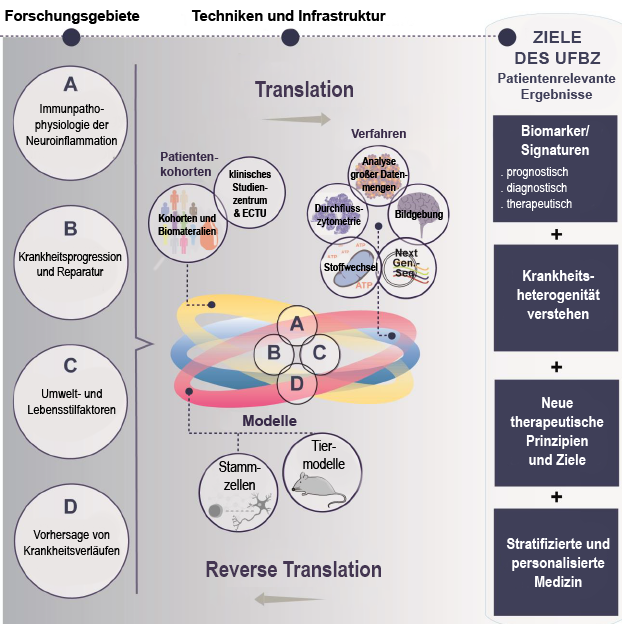
Einbinden der detaillierten Analyse von Immunprozessen bei (neuro)entzündlichen Erkrankungen
Die mehrdimensionale Analyse von MS-Immunzellen mittels Durchflusszytometrie hat ergeben: MS hat vier verschiedene immunologische Endophänotypen, also neurobiologische Krankheitskorrelate. Sie sind zeitlich stabil und durch Gene beeinflusst. Insbesondere zwei dieser Immunsignaturen – der entzündliche und der degenerative Typ – gehen mit spezifischen klinischen Charakteristika einher. Immuntherapien wirken bei diesen Formen je unterschiedlich. Basierend auf dieser bahnbrechenden Erkenntnis wollen wir im UFBZ krankheitsspezifische Endophänotypen bei einer Reihe entzündlicher Erkrankungen identifizieren. Zudem sollen Scores zu Prognose des Krankheitsverlaufs entwickelt und validiert werden. Dazu dienen Daten, die bereits in der Pilotphase gesammelt wurden, aber auch solche aus aktuell laufenden Projekten und Kohorten.
Dieses Vorgehen soll (1) umfassende Einblicke in die spezifische Immunbiologie gewähren, die ganz unterschiedlichen neurologischen und neuropsychiatrischen Krankheiten zugrunde liegt. Dabei reicht die Spanne von neuroinflammatorischen Krankheiten wie Neuromyelitis optica, Susac Syndrom, Autoimmunenzephalitis und Myasthenia gravis über organspezifische Autoimmunkrankheiten wie Rheumatoide Arthritis und Psoriasis bis hin zu psychiatrischen Diagnosen, bei denen eine Veränderung der peripheren Immunsignatur bekannt ist, wie z.B. affektive Störungen. Es gilt (2) herauszufinden, ob eine spezifische Immunsignatur während der Behandlung hilft den Behandlungserfolg vorherzusagen. Zuletzt soll (3) der Forschungsansatz so angepasst werden, dass man die Untersuchungen einfacher in die klinische Routine integrieren kann.
Rolle entzündlicher Mechanismen im Kontext von Progression und Regeneration
Wann sind Reparaturmechanismen erfolgreich? Wann scheitern sie? Wir wollen die Faktoren besser verstehen, die Progression und Regeneration bei chronischen Entzündungskrankheiten bestimmen. Dazu charakterisieren wir gelungene im Vergleich zu fehlgeschlagenen Reparaturmechanismen in verschiedenen Geweben/Organen. Mit diesem translationalen Ansatz können wir organspezifische sowie -übergreifende Mechanismen identifizieren, die die Gewebereparatur fördern.
Veränderung der Umwelt und des Lebensstils (im Gegensatz zur Genetik) im Kontext der Autoimmunpathophysiologie
Viele Autoimmunerkrankungen entwickeln sich vermutlich aus einem Zusammenspiel von genetischen und Umweltfaktoren. Um herauszufinden welcher der beiden Faktoren welche Rolle spielt, sind Zwillingsstudien besonders geeignet. Bereits in der Pilotphase konnten wir so eine bestimmte Population entzündlicher CD4+-Zellen entdecken, die bereits in der Vorstufe der MS auftritt. Die nun laufende Konsolidierungsphase soll klären: Wie beeinflussen Umweltfaktoren die Entstehung und weitere Entwicklung von Autoimmunität im ZNS? Und wie lassen sich diese Faktoren durch gezielte Therapiemaßnahmen beeinflussen? Zwei wichtige Umweltfaktoren sind konjugierte Linolsäure und UV-Licht. Beide haben eine nachgewiesene Wirkung auf das Immunsystem. Im UFBZ planen wir nun eine klinische Studie der Phase II, um den Effekt von CLA und Probiotika als Zusatz zur Immuntherapie bei Patient*innen mit schubförmiger MS zu untersuchen.
Seit einigen Jahren ist zudem ein anderer Umweltfaktor ins Interesse der Wissenschaft gerückt: Der Zellstoffwechsel (Zellmetabolismus). Studien haben gezeigt, dass der Metabolismus von gesunden und erkrankten Immunzellen unterschiedlich ist, was wiederum Aufschluss über die Mechanismen der Autoimmunität geben kann. Dieses hochaktuelle Thema wird nun im UFBZ Neuroinflammation intensiver bearbeitet.
Vorhersage von Krankheitsverläufen bei affektiven Störungen durch kombinierte Analyse von Bildgebungsmerkmalen und Immunsignaturen
Die schwere Depression (MDD) gehört ebenso dazu wie die bipolare Störung (BD) – früher „manische“ Depression genannt: Die Rede ist von affektiven Störungen (AD). Sie betreffen fast jeden zehnten Menschen in Deutschland und gehen mit einem hohen individuellen Leidensdruck einher. Obwohl so verhältnismäßig viele Menschen teils schwer erkranken, sind die Mechanismen und Faktoren, die den langfristigen Krankheitsverlauf beeinflussen, bisher kaum verstanden. Der im Oktober 2024 gegründete Sonderforschungsbereich TRR 393 will dieses Defizit beheben. Unter dem Titel „Trajektorien affektiver Erkrankungen: Kognitiv-emotionale Mechanismen von Symptomänderungen“ wollen Wissenschaftler*innen aus Marburg und Münster
- den Verlauf von Rückfällen und Remissionen bei der AD ermitteln,
- kognitiv-emotionale Mechanismen und neurobiologische Korrelate akuter Symptomveränderungen bestimmen und
- auf Krankheitsmechanismen basierende Interventionen untersuchen.
Das Vorhaben wird vorerst bis Ende 2028 von der Deutschen Forschungsgemeinschaft gefördert.
Vorarbeiten im UFBZ haben den Grundstein für dieses Großprojekt gelegt. Um die Längsschnittverläufe affektiver Störungen zu untersuchen, betrachten wir im UFBZ Veränderungen in der Gehirnstruktur, Immunsignaturen und Umwelteinflüsse über lange Zeiträume. Mithilfe von maschinellem Lernen und integrierten neuroimaging- und immunologischen Analysen konnten wir zeigen: Treten affektive Störungen häufiger auf, sind mit einem größeren Volumenverlust der grauen Substanz verbunden. Auch Risikofaktoren wie Misshandlung in der Kindheit können den Krankheitsverlauf beeinflussen, indem sie sich auf die kortikale Struktur auswirken. In der DFG-geförderten Forschergruppe „Neurobiologie affektiver Störungen“ (FOR 2107) kombinieren wir Langzeitdaten aus der Bildgebung mit immunologischen Analysen, um den Krankheitsverlauf vorherzusagen.
Um diese Projekte umzusetzen, arbeiten die beteiligten Organisationen teils seit mehr als einem Jahrzehnt interdisziplinär zusammen. In dieser Zeit sind wertvolle Ressourcen entstanden:
- detailliert charakterisierte Proben von tausenden Patienten, die alle Aspekte der ZNS-Entzündung abbilden und auch den Krankheitsverlauf auf molekularer Ebene sichtbar machen,
- eine Infrastruktur für die Durchführung klinischer Studien aller Stadien, die teilweise gemeinsam mit der Medizinischen Fakultät Münster aufgebaut wurde (Early Clinical Trial Unit)
- das Wissen und die Methoden, um verschiedene biologische Kompartimente auszuwerten und für Studien nutzbar zu machen
- eine vom UFBZ geförderte Arbeitsgruppe zum Thema Stammzelltechnologien (AG-Leiter Yotam Menuchin-Lasowski). Mit den dort verwendeten Methoden lassen sich Interaktionen zwischen verschiedenen Zelltypen – wie Neuronen, Glia und peripheren Immunzellen – darstellen. So können entzündliche Abläufe im zentralen Nervensystem genauer untersucht werden als je zuvor.
- eine enge Zusammenarbeit mit Experten auf dem Gebiet der künstlichen Intelligenz und der Computerbiologie, um große multimodale Datensätze zu analysieren
- eine Junior-Stiftungsprofessur (W1) für Systembiologie bei neuroinflammatorischen Erkrankungen (Prof. Christian Thomas)