Forschungsschwerpunkte
Androprotect - Zelluläre und klinische Aspekte
Androprotect (Webseite zu klinischen Aspekten) ist das deutschlandweite Netzwerk für den Fertilitätserhalt bei Jungen. Es wurde gegründet, um auch prä-pubertären Jungen die Möglichkeit zu geben ihren Wunsch auf Vaterschaft in Zukunft zu verwirklichen. Da die Hodengewebe dieser Jungen noch keine Spermien produzieren, können vor einer gonadotoxischen Therapie Gewebefragmente kryokonserviert werden, die die Vorläuferzellen (Spermatogonien) enthalten. Um aus diesen Spermatogonien perspektivisch Spermien gewinnen zu können, widmen wir uns den folgenden Forschungsaspekten:
I. Einfluss von Erkrankung und/oder Behandlung auf Spermatogonien in den verschiedenen Patientengruppen
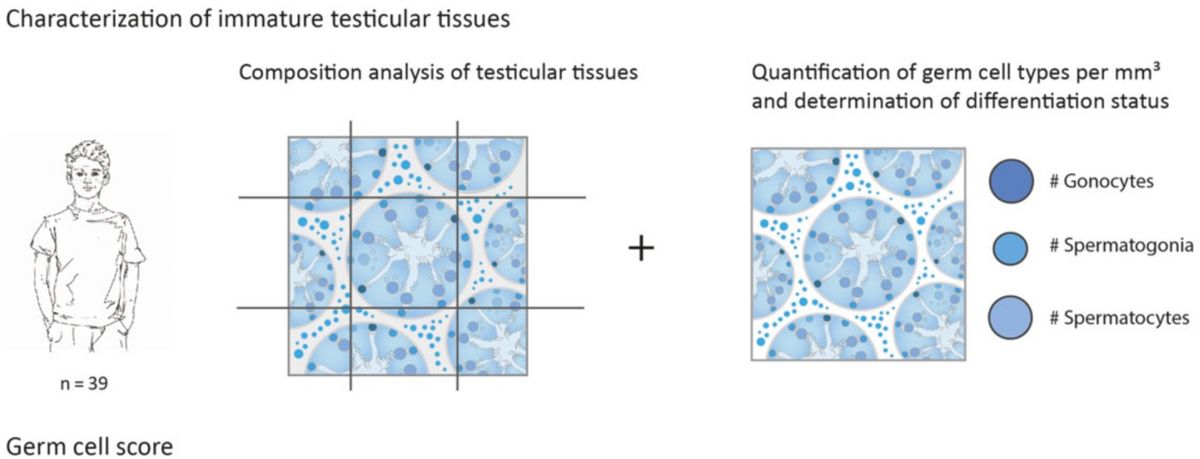
Die Analyse der Gewebeintegrität und der Anzahl der verschiedenen Keimzelltypen, mit besonderem Fokus auf die Spermatogonien, ist essentieller Bestandteil des Androprotect Programms (Heckmann et al. 2018). Die Patientenkollektive der weltweiten Fertilitätsnetzwerke für Jungen sind sehr heterogen. Während diese Netzwerke initial mit Blick auf onkologische Patienten gegründet wurden, bei denen die Chemo- oder Strahlentherapie zu einem Verlust der Spermatogonien führen kann, werden inzwischen auch Patienten mit gutartigen Bluterkrankungen und beispielsweise Gewebe von Trans*Frauen miteingeschlossen. In diesem Forschungsbereich analysieren wir die Spermatogonien-Anzahl für die kryokonservierten Hodengewebe in Zusammenhang mit den relevanten klinischen Daten. Die gewonnenen Informationen werden verwendet um die Chance zu beurteilen, dass aus den jeweiligen Geweben perspektivisch Spermien gewonnen werden können.
Ausgewählte Literatur:
Benninghoven-Frey KM, Neuhaus N, Lahtinen AK, Krallmann C, Portela JMD, Jarisch A, Nordhoff V, Soave A, Ba Omar HAM, Sundin M, Langenskiöld C, Kliesch S, Stukenborg JB, Jahnukainen K. (2022) Early testicular maturation is sensitive to depletion of spermatogonial pool in sickle cell disease. Haematologica. 107(4):975-979.
Funke M, Yang Y, Lahtinen A, Benninghoven-Frey K, Kliesch S, Neuhaus N, Stukenborg JB, Jahnukainen K. (2021) Z-scores for comparative analyses of spermatogonial numbers throughout human development. Fertil Steril. 116(3):713-720.
II. Fertilitätsprotektion bei Trans*Frauen

Status der Spermatogenese in Trans*Frauen zum Zeitpunkt der geschlechtsangleichenden Operation (Schneider et al., 2019). Die geschlechtsangleichende Hormontherapie bei Trans*Frauen führt zu einer Regression der Spermatogenese. Während bei einer überraschend hohen Prozentzahl dieser Personen auch zum Zeitpunkt der geschlechtsangleichenden Operation noch Spermien in den Hodengeweben gefunden werden können, zeigt der Großteil der Gewebe einen Arrest auf der Stufe der Spermatogonien oder Spermatozyten.
Daher ist der Aspekt der Fertilitätspräservation von besonderer Bedeutung. Eine Kryokonservierung von Spermien vor der Behandlung ermöglicht die Verwendung dieser Zellen im Rahmen einer künstlichen Befruchtung zu einem späteren Zeitpunkt. Als experimentellen Ansatz kann auch die Einlagerung der Hodengewebe mit den gegebenenfalls vorhandenen Spermatogonien in Betracht gezogen werden. Unsere Forschung in diesem Bereich fokussiert sich auf die Charakterisierung der Spermatogonien unter Verwendung von Zellkulturansätzen und Marker-Analysen.Ausgewählte Literatur:
Schneider F, Scheffer B, Dabel J, Heckmann L, Schlatt S, Kliesch S, Neuhaus N. Options for Fertility Treatments for Trans Women in Germany. J Clin Med. 2019 May 22;8(5):730. https://doi.org/10.3390/jcm8050730
Schneider FJ, Dabel J, Wistuba J, Kliesch S, Schlatt S, Neuhaus N. New perspectives on fertility in transwomen with regard to spermatogonial stem cells. Reprod Fertil. 2022 Dec 1:RAF-22-0022.
III. Spermatogonien-basierte Ansätze für eine Refertilisierung
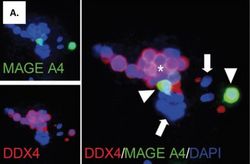
Menschliche Spermatogonien in vitro: Immunfluoreszenzfärbungen von menschlichen Keimzellen für MAGE A4 (grün) und DDX4 (rot; Kossack et al. 2013). Derzeit werden drei Spermatogonien-basierte Ansätze weiterentwickelt, um aus den eingelagerten Geweben prä-pubertärer Jungen Spermien zu gewinnen und eine Refertilisierung zu erreichen. Die Isolierung, in vitro Kultur und Vermehrung von Spermatogonien ist Voraussetzung für eine Keimzelltransplantation. Die Re-transplantation der Spermatogonien, nach einer erfolgreichen Behandlung von Krebspatienten, soll dabei zu einer Neubesiedlung der Samenkanälchen durch die Spermatogonien führen und somit zu einer Refertilisierung. Der zweite Ansatz beruht auf der Rücktransplantation von Gewebefragmenten in den Hoden der Patienten, was basierend auf Daten aus dem Tiermodell zu einer Differenzierung der Spermatogonien in Spermien führt. Die in vitro Spermatogenese, bei der die Differenzierung der Keimzellen gänzlich in Kultur erfolgt bildet den dritten Ansatz. Die Gewebetransplantation und in vitro Spermatogenese sind Forschungsbestandteil der Arbeitsgruppe von Prof. Schlatt.

Expressionsprofile von menschlichen Keimzellen zu unterschiedlichen Entwicklungszeitpunkten (Sharma et al., 2019). In den letzten Jahren haben wir erfolgreich Ansätze für die Isolierung, Kultur und Charakterisierung von menschlichen Spermatogonien etabliert. Einzelzellanalyseansätze ermöglichen es nun, bisher unbekannte Eigenschaften von Spermatogonien zu entdecken, die im Zuge von Populationsanalysen verdeckt geblieben sind. Mit diesen Erkenntnissen können perspektivisch die Protokolle für die in vitro Kultur verbessert werden, damit eine Vermehrung der Spermatogonien für eine Keimzelltransplantation gelingen kann.
Ausgewählte Literatur:
Neuhaus N, Schlatt S. Stem cell-based options to preserve male fertility. Science. 2019 Mar 22;363(6433):1283-1284. https://doi.org/10.1126/science.aaw6927Swati Sharma, Joachim Wistuba, Tim Pock, Stefan Schlatt, Nina Neuhaus, Spermatogonial stem cells: updates from specification to clinical relevance, Human Reproduction Update, Volume 25, Issue 3, May-June 2019, Pages 275–297, https://doi.org/10.1093/humupd/dmz006
Neuhaus N, Yoon J, Terwort N, Kliesch S, Seggewiss J, Huge A, Voss R, Schlatt S, Grindberg RV, Schöler HR. Single-cell gene expression analysis reveals diversity among human spermatogonia. Mol Hum Reprod. 2017 Feb 10;23(2):79-90. https://doi.org/10.1093/molehr/gaw079
Keimbahnstammzellen in der Entwicklung
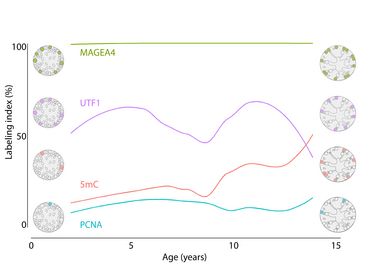
Dynamik der menschlichen Spermatogonien-Population in der normalen Hodenentwicklung. Die Daten basieren auf dem Anteil (in %) der Zellen, die eine Expression von Keimzellmarkern (UTF1, MAGEA4), einem Methylierungsmarker (5mC) und einem Proliferationsmarker (PCNA) auf Proteinebene aufweisen (Modifiziert von Portela et al., 2020). Spermatogoniale Stammzellen bilden die Grundlage für die Spermatogenese. Ein besseres Verständnis dieser Zellen ist Voraussetzung dafür, dass diese Zellen zukünftig im Bereich der Fertilitätsbewahrung eingesetzt werden können. Um entwicklungsspezifische Veränderungen der Spermatogonien zu entschlüsseln, verwenden wir hochauflösenden Einzelzell-Analysen in Kombination mit Immunohistochemischen/-fluoreszenz-Analysen.
Einzelzellexpressionsanalysen von Keimzellen unterschiedlicher Entwicklungsstufen werden im Rahmen eines IMF-Projektes (Mapping primate male germ cell development using single-cell transcriptomics) und in enger Kooperation mit Dr. Sandra Laurentino durchgeführt.
Ausgewählte Literatur:
Portela JMD, Heckmann L, Wistuba J, Sansone A, Pelt AMMV, Kliesch S, Schlatt S, Neuhaus N. Development and Disease-Dependent Dynamics of Spermatogonial Subpopulations in Human Testicular Tissues. J Clin Med. 2020 Jan 14;9(1):224. https://doi.org/10.3390/jcm9010224
Keimbahnstammszellen im Hoden fertiler und infertiler Männer

Daten einer Einzelzellanalyse mittels RNA-Sequenzierung (10x Genomics) vom Hodengewebe eines Klinefelter Patienten. Im tSNE-Plot sind die unterschiedlichen Zelltypen basierend auf ihrem Transkriptionsprofil farblich als separate Cluster repräsentiert. Eine weitergehende Analyse der Keimzellen zeigte, dass diese unterschiedlichen Differenzierungsstufen der normalen Spermatogenese zugeordnet werden können (Aus Laurentino et al., 2019). 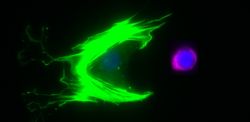
Menschliche Keimzelle (DDX4+, rot) mit somatischer Hodengewebszelle (SMA+, grün). Unser Forschungsziel ist es, die epigenetischen und transkriptionellen Eigenschaften von Spermatogonien im erwachsenen Mann zu entschlüsseln. Um die Heterogenität der Population abbilden zu können verwenden wir einzelzellauflösende Analyseansätze.
Das Verständnis des Normalzustandes ist die Voraussetzung dafür, dass die Ursachen für die veränderten Eigenschaften in den Spermatogonien und ihrer Nische in Infertilitätspatienten aufgeklärt werden können. Diese Untersuchungen werden im Rahmen der klinischen Forschergruppe CRU326 ‚Male Germ Cells from Genes to Function durchgeführt.‘
Mehr über das CRU-Projekt gibt es hier
Ausgewählte Literatur:
Laurentino S, Heckmann L, Di Persio S, Li X, Meyer Zu Hörste G, Wistuba J, Cremers JF, Gromoll J, Kliesch S, Schlatt S, Neuhaus N. High-resolution analysis of germ cells from men with sex chromosomal aneuploidies reveals normal transcriptome but impaired imprinting. Clin Epigenetics. 2019 Aug 28;11(1):127. https://doi.org/10.1186/s13148-019-0720-3Di Persio S, Neuhaus N. (2023) Human spermatogonial stem cells and their niche in male (in)fertility: novel concepts from single-cell RNA-sequencing. Hum Reprod. 38(1):1-13.
Sara Di Persio,Tobias Tekath,Lara Marie Siebert-Kuss,Jann-Frederik Cremers,Joachim Wistuba,Xiaolin Li,Gerd Meyer zu Hörste,Hannes C.A. Drexler,Margot Julia Wyrwoll,Frank Tüttelmann,Martin Dugas,Sabine Kliesch,Stefan Schlatt,Sandra Laurentino, Nina Neuhaus (2021) Single-cell RNA-seq unravels alterations of the human spermatogonial stem cell compartment in patients with impaired spermatogenesis. Cell Reports Medicine. 2(9):100395.

