







Wie finden Spermien eigentlich die Eizelle – und was müssen sie tun, um diese zu befruchten?
Diese Fragen haben wir zum Kern unserer Forschung gemacht: Wir versuchen, das komplexe Netzwerk aus Rezeptoren, Ionenkanälen und Botenstoffen zu entschlüsseln, mit denen Spermien Signale aus ihrer Umgebung wahrnehmen. Dazu setzen wir auf ein breites Methodenspektrum, das von elektrophysiologischen Ableitungen über fluoreszenzoptische Messungen intrazellulärer Parameter bis hin zu computerunterstützten Motilitätsuntersuchungen und Proteinbiochemie reicht. Spermien dienen uns dabei nicht nur als faszinierende Modellorganismen für zelluläre Signalverarbeitungswege: Mit unserer Arbeit tragen wir zu einem detaillierteren Verständnis des Befruchtungsvorgangs bei – und nutzen dieses Wissen, um Ursachen männlicher Unfruchtbarkeit zu entschlüsseln und neue diagnostische Tests zu entwickeln.

Wir untersuchen die Signalverarbeitungswege, mit denen Spermien Änderungen in ihrer physikochemischen Umgebung in Verhaltensantworten übersetzen. Mit einem breiten Repertoire zellbiologischer, proteinbiochemischer, fluoreszenzoptischer und elektrophysiologischer Methoden fokussieren wir uns hierbei insbesondere auf die Untersuchung der chemosensorischen Mechanismen in menschlichen Spermien. Mit der Erforschung der Wirkung von Botenstoffen, die in die Samenflüssigkeit und den Eileiter abgegeben werden, sowie von Alltags- und Umweltchemikalien auf menschliche Spermien hat unsere Arbeitsgruppe auf diesem Gebiet bereits wichtige Fragen beantwortet.
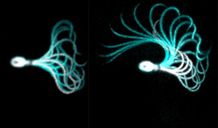
Wie übersetzen Spermien physikochemische Signale aus ihrer Umgebung in Änderungen ihres Schwimmverhaltens? Wie orientieren sich Spermien auf ihrem Weg zur Eizelle, wie durchbrechen sie ihre schützenden Hüllschichten, um sie zu befruchten? Ein Ensemble mikroskopischer Technologien, von Hochgeschwindigkeits-Mikroskopkameras bis hin zu optischen LASER-basierten Pinzetten und mikrohydraulischen Strömungskanälen sowie Aufbauten für kinetische Stopped-Flow-Mikroskopie, gestattet es uns, das Schwimmverhalten von Spermien im Detail zu untersuchen. Indem wir unser Wissen und unsere Erfahrung ständig neu unserer Kreativität und Neugier zur Seite stellen, entwickeln wir die technischen Lösungen, um Spermien-Chemotaxis und -Rheotaxis zu untersuchen – die Orientierung der Spermien anhand von chemischen Wegweisern und Flüssigkeitsbewegungen im weiblichen Genitaltrakt.

Ausgewählte Literatur:
Schiffer, C., Rieger, S., Brenker, C., Young, S., Hamzeh, H., Wachten, D., Tuttelmann, F., Ropke, A., Kaupp, U. B., Wang, T., Wagner, A., Krallmann, C., Kliesch, S., Fallnich, C. & Strunker, T. (2020) "Rotational motion and rheotaxis of human sperm do not require functional CatSper channels and transmembrane Ca(2+) signaling" The EMBO journal 39, e102363. doi.org/10.15252/embj.2019102363
Brenker, C., Schiffer, C., Wagner, I. V., Tuttelmann, F., Ropke, A., Rennhack, A., Kaupp, U. B. & Strunker, T. (2018) "Action of steroids and plant triterpenoids on CatSper Ca(2+) channels in human sperm" Proceedings of the National Academy of Sciences of the United States of America 115, E344-E346. doi.org/10.1038/emboj.2012.30
Schiffer, C., Muller, A., Egeberg, D. L., Alvarez, L., Brenker, C., Rehfeld, A., Frederiksen, H., Waschle, B., Kaupp, U. B., Balbach, M., Wachten, D., Skakkebaek, N. E., Almstrup, K. & Strunker, T. (2014) "Direct action of endocrine disrupting chemicals on human sperm" EMBO reports. doi.org/10.15252/embr.201438869
Brenker, C., Goodwin, N., Weyand, I., Kashikar, N. D., Naruse, M., Krahling, M., Müller, A., Kaupp, U. B. & Strünker, T. (2012) "The CatSper channel: a polymodal chemosensor in human sperm" EMBO J. 31, 1654-1665. doi.org/10.1038/emboj.2012.30
Strünker, T., Goodwin, N., Brenker, C., Kashikar, N. D., Weyand, I., Seifert, R. & Kaupp, U. B. (2011) "The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm" Nature 471, 382-386. doi.org/10.1038/nature09769

Wir untersuchen die molekulare und zelluläre Pharmakologie, Physiologie und Biophysik der Ionenkanäle und Transporter, die die Funktionen von Spermien während der Befruchtung steuern. Im Kern unserer Forschung steht dabei der CatSper-Kanal, der als polymodaler Sensor für eine Vielzahl physikochemischer Reize das Spermienverhalten über die Regulierung des intrazellulären Kalziumhaushalts steuert. CatSper ist eingebettet in ein komplexes Signalverarbeitungsnetzwerk von Proteinen: Der Kaliumkanal Slo3 und der Protonenkanal Hv1, die Schlüsselstellungen bei der Regulation des Membranpotenzials bzw. intrazellulären pH-Werts einnehmen, sind ebenfalls Gegenstände unserer wissenschaftlichen Arbeit. Mit der Entwicklung neuer Inhibitoren für Spermien-Ionenkanäle stellt unsere Arbeitsgruppe nicht nur der reproduktionsbiologischen Grundlagenforschung leistungsfähige Werkzeuge zur Verfügung, sondern legt darüber hinaus Grundsteine für die Entwicklung neuer Kontrazeptiva.
Ausgewählte Literatur:
Wang, T., Young, S., Krenz, H., Tüttelmann, F., Röpke, A., Krallmann, C., Kliesch, S., Zeng, X., Brenker, C., & Strünker, T. (2020) "The Ca2+ channel CatSper is not activated by cAMP/PKA signaling but directly affected by chemicals used to probe the action of cAMP and PKA." Journal of Biological Chemistry. doi.org/10.1074/jbc.RA120.013218
Brenker, C., Zhou, Y., Muller, A., Echeverry, F.A., Trotschel, C., Poetsch, A., Xia, X.M., Bönigk, W., Lingle, C.J., Kaupp, U.B. & Strünker, T. (2014) "The Ca2+-activated K+ current of human sperm is mediated by Slo3" eLife 3. doi.org/10.7554/eLife.01438
Rennhack A, Schiffer C, Brenker C, Fridman D, Nitao ET, Cheng YM, Tamburrino L, Balbach M, Stölting G, Berger TK, Kierzek M, Alvarez L, Wachten D, Zeng XH, Baldi E, Publicover S, Kaupp UB, Strünker T (2018). "A novel cross-species inhibitor to study the function of CatSper Ca2+ channels in sperm." Br J Pharmacol. doi.org/10.1111/bph.14355
Unsere Forschung zielt auch darauf ab, neue Diagnostika zur Früherkennung männlicher Unfruchtbarkeit und evidenzbasierten Therapieauswahl in der Kinderwunschmedizin zu entwickeln.
Im Rahmen eines durch "EFRE.NRW" und im Programm "EXIST-Forschungstransfer" geförderten Projekts hat ein Projektteam geleitet von Dr. Christian Schiffer und mit Dr. Samuel Young, ehemalige Mitglieder und nun Gastwissenschaftler in unserer Arbeitsgruppe, bereits einen Labortest - den CatSper-Test - in ein CE-konformes Medizinprodukt überführt. Mithilfe des “CatSper-Tests” lässt sich eine CatSper-bedingte Unfruchtbarkeit erkennen.
Erfahren Sie mehr über den CatSper-Test auf den Seiten unserer Ausgründung Truion.
Ausgewählte Literatur:
Young, S.*, Schiffer, C.*, Wagner, A., Patz, J., Potapenko, A., Herrmann, L., Nordhoff, V., Pock, T., Krallmann, C., Stallmeyer, B., Röpke, A., Kierzek, M., Biagioni, C., Wang, T., Haalck, L., Deuster, D., Hansen, J. N., Wachten, D., Risse, B., Behre, H. M., Schlatt, S., Kliesch, S., Tüttelmann, F.*, Brenker, C.*, Strünker, T.* (2024) “Human fertilization in vivo and in vitro requires the CatSper channel to initiate sperm hyperactivation” Journal of Clinical Investigation 134(1):e173564 doi.org/10.1172/JCI173564
Schiffer, C., Rieger, S., Brenker, C., Young, S., Hamzeh, H., Wachten, D., Tuttelmann, F., Ropke, A., Kaupp, U. B., Wang, T., Wagner, A., Krallmann, C., Kliesch, S., Fallnich, C. & Strunker, T. (2020) "Rotational motion and rheotaxis of human sperm do not require functional CatSper channels and transmembrane Ca(2+) signaling" The EMBO journal 39, e102363. doi.org/10.15252/embj.2019102363