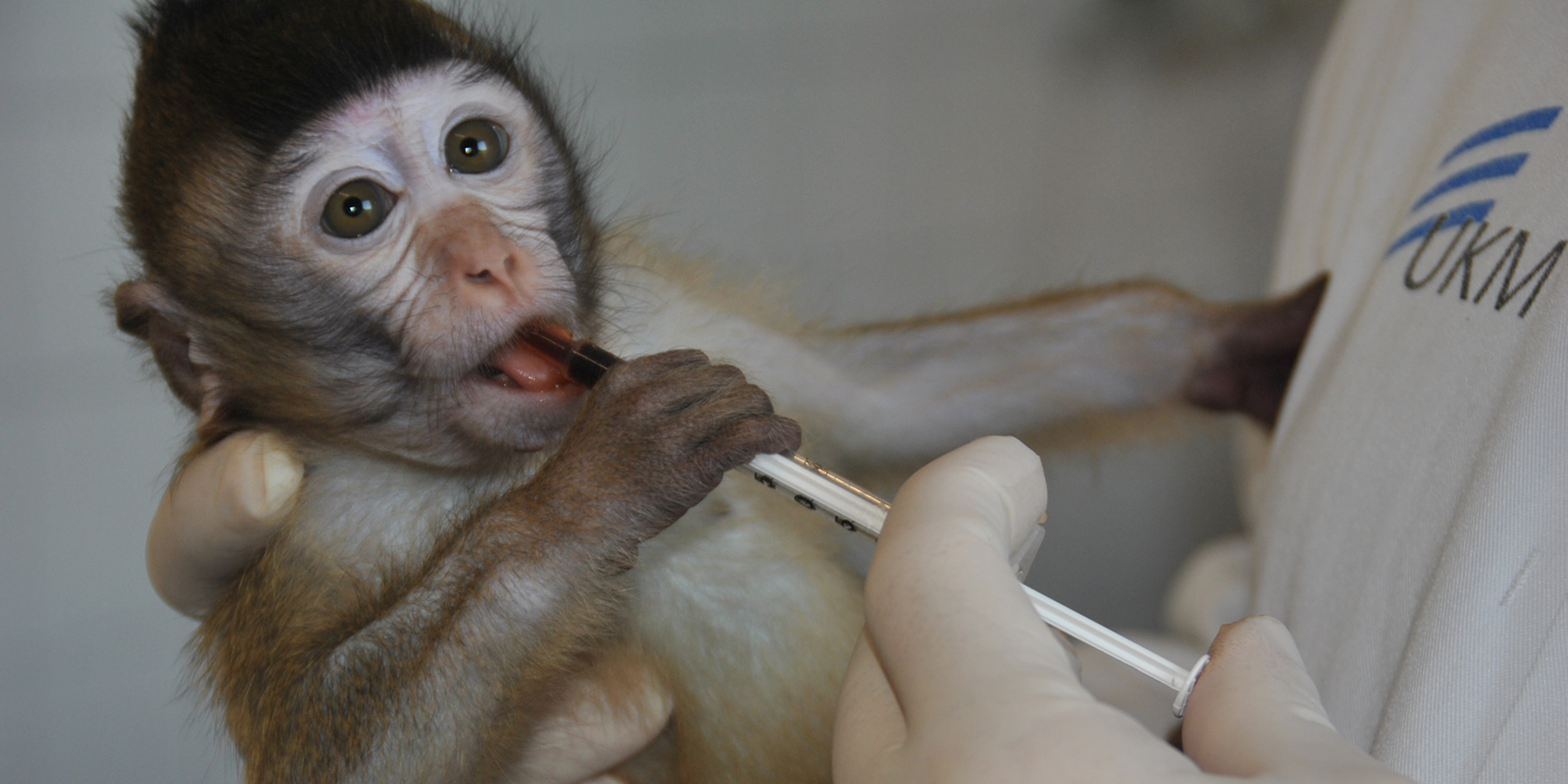
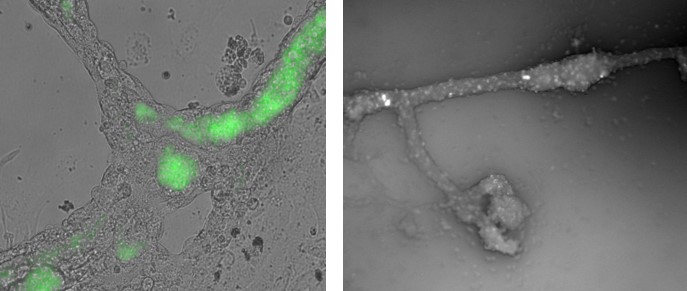




Die Fertilität männlicher Säugetiere beruht auf einer täglichen Produktion von Millionen von Spermien. Die Spermatogenese wird gesteuert durch ein Zusammenspiel von Hormonen. Die AG Schlatt erforscht die physiologischen und zellulären Aspekte bei der Produktion von Spermien. Die Rolle der testikulären Stammzellen und ihrer Nischen steht dabei im Zentrum. Das Spektrum der Arbeiten reicht von der Grundlagenforschung bis zur Anwendung beim Menschen. Neben dem Einsatz von Tiermodellen (Nager, Affen) und humanen Geweben werden Alternativmethoden (Organoide, Microfluidic-Chips) für die experimentellen Arbeiten entwickelt und verwendet.
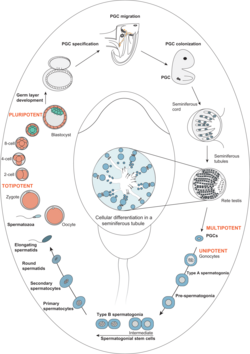
Spermatogonien sind die diploiden Zellen an der Basis des Keimepithels im Hoden. Sie entstehen aus pluripotenten Vorläuferzellen, die sich während der sexuell männlichen Differenzierung zu Stammzellen entwickeln. Aus diesen Stammzellen entstehen durch mitotische Vermehrung ab der Pubertät unzählig viele differenzierende Keimzellen und treten in die Meiose ein. Die Arbeitsgruppe Schlatt beschäftigt sich mit allen Aspekten der Biologie von Spermatogonien. Hauptaugenmerk der aktuellen Forschung ist die Untersuchung grundlegender Mechanismen bei der Bildung und Regulation von Spermatogonien.
Forschungsaspekte:
Ausgewählte Übersichtsarbeiten:
Sharma S, Wistuba J, Pock T, Schlatt S, Neuhaus N. Spermatogonial stem cells: updates from specification to clinical relevance. Hum Reprod Update. 2019;25:275-297. doi: 10.1093/humupd/dmz006
Sharma S, Portela JMD, Langenstroth-Röwer D, Wistuba J, Neuhaus N, Schlatt S. Male germline stem cells in non-human primates. Primate Biol. 2017; 4:173-184. doi: 10.5194/pb-4-173-2017
Schlatt S, Ehmcke J. Regulation of spermatogenesis: an evolutionary biologist's perspective. Semin Cell Dev Biol. 2014, 29:2-16. doi: 10.1016/j.semcdb.2014.03.007
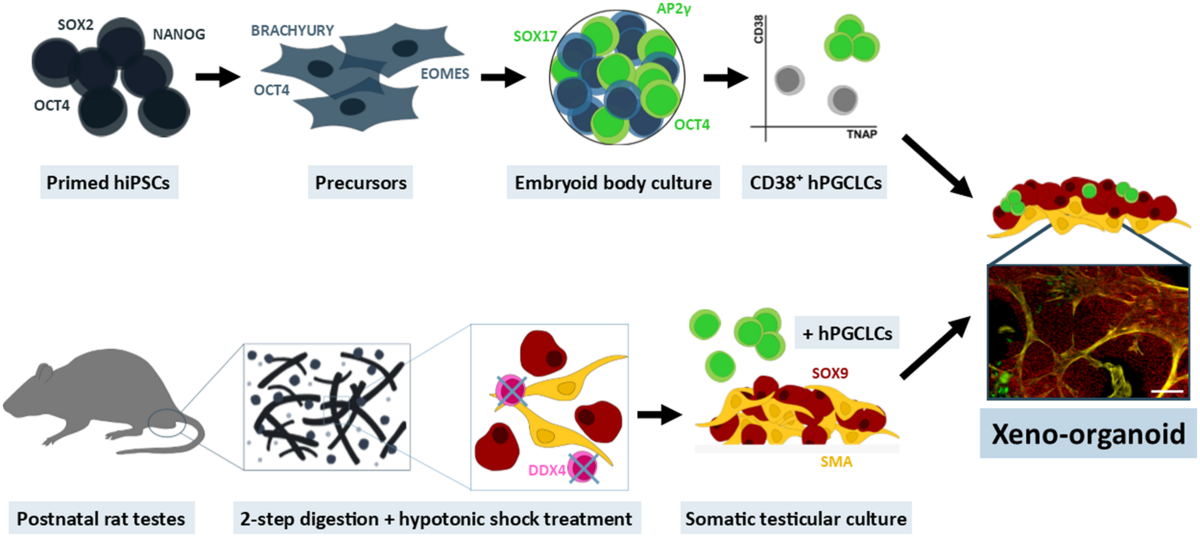

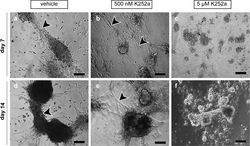
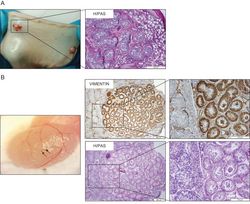
In vitro Systeme für die Generierung von Spermien sind seit über 100 Jahren im Fokus der Wissenschaft. Leider gibt es bis heute keine effizienten Verfahren oder Systeme, mit denen eine vollständige Spermatogenese von der Stammzelle bis zum reifen Spermium erzielt werden kann. Solche Verfahren wären zur experimentellen Erforschung der Keimzelldifferenzierung ebenso relevant wie zur Entwicklung von in vitro Methoden zur Gewinnung von Keimzellen. Entsprechende Verfahren kämen in der Veterinär- und Humanmedizin zum Einsatz. Die Arbeitsgruppe führt ein Programm fort, mit dem seit mehreren Jahrzehnten die Entwicklung von Verfahren zur Reifung von immaturen Hoden und die Induktion der Spermatogenese erforscht wird. Dabei kommen sowohl unterschiedliche Tiermodelle als auch in vitro Ansätze zum Einsatz. In jüngster Zeit stehen dabei Methoden zur Transplantation von Zellen und Geweben sowie die Generierung von Organoiden aus Hodengewebe im Vordergrund.
Forschungsaspekte:
Ausgewählte Übersichtsarbeiten:
Sharma S, Venzac B, Burgers T, Le Gac S, Schlatt S. Microfluidics in male reproduction: is ex vivo culture of primate testis tissue a future strategy for ART or toxicology research? Mol Hum Reprod. 2020; 26:179-192. doi: 10.1093/molehr/gaaa006
Stukenborg JB, Schlatt S, Simoni M, Yeung CH, Elhija MA, Luetjens CM, Huleihel M, Wistuba J. New horizons for in vitro spermatogenesis? An update on novel three-dimensional culture systems as tools for meiotic and post-meiotic differentiation of testicular germ cells. Mol Hum Reprod. 2009;15:521-9. doi: 10.1093/molehr/gap052
Florian Schneider, Bettina Scheffer, Jennifer Dabel, Laura Heckmann, Stefan Schlatt, Sabine Kliesch, Nina Neuhaus. Options for Fertility Treatments for Trans Women in Germany. J Clin Med. 2019; 8: 730. doi:10.3390/jcm8050730
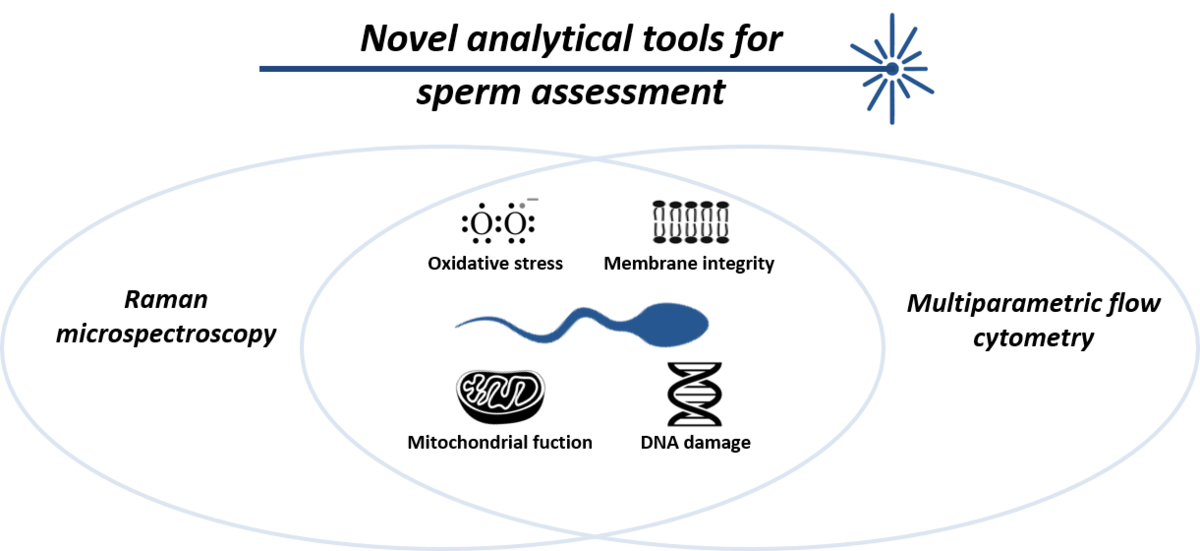
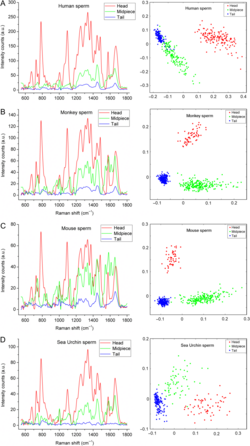
Spermien und Keimzellen lassen sich mittels optischer Methoden untersuchen und ermöglichen neue Verfahren zur Charakterisierung und Selektion. Im Vordergrund der Arbeiten stehen die multispektrale Analyse und flowcytometrische Auftrennung von Zellfraktionen sowie die Anwendung der Raman-Spektroskopie zur Bestimmung der biochemischen Komponenten von Zellen. Primär werden mit beiden Verfahren zurzeit menschliche Spermien untersucht. Es ist das primäre Ziel, vor allem in der Arbeitsgruppe von Dr. Raul Da Costa, mittels dieser Verfahren oder einer Kombination aus beiden neue diagnostische Verfahren zur Charakterisierung von Spermien zu entwickeln.
Forschungsaspekte:
Ausgewählte Publikationen:
Amaral S, Da Costa R, Wübbeling F, Redmann K, Schlatt S. Raman micro-spectroscopy analysis of different sperm regions: a species comparison. Mol Hum Reprod. 2018;24:185-202. doi: 10.1093/molehr/gax071.
Da Costa R, Amaral S, Redmann K, Kliesch S, Schlatt S. Spectral features of nuclear DNA in human sperm assessed by Raman Microspectroscopy: Effects of UV-irradiation and hydration. PLoS One. 2018; 13:e0207786. doi: 10.1371/journal.pone.0207786.
Sánchez V, Redmann K, Wistuba J, Wübbeling F, Burger M, Oldenhof H, Wolkers WF, Kliesch S, Schlatt S, Mallidis C. Oxidative DNA damage in human sperm can be detected by Raman microspectroscopy. Fertil Steril. 2012;98(5):1124-9.e1-3. doi: 10.1016/j.fertnstert.2012.07.1059.
Mallidis C, Sanchez V, Wistuba J, Wuebbeling F, Burger M, Fallnich C, Schlatt S. Raman microspectroscopy: shining a new light on reproductive medicine. Hum Reprod Update. 2014;20:403-14. doi: 10.1093/humupd/dmt055.
