Forschungsschwerpunkte
Evolutive Anpassungen von Spermatogenese und testikulären Strukturen - spermatogoniale Stammzellsysteme, Reproduktionsendokrinologie und Spermienkompetition
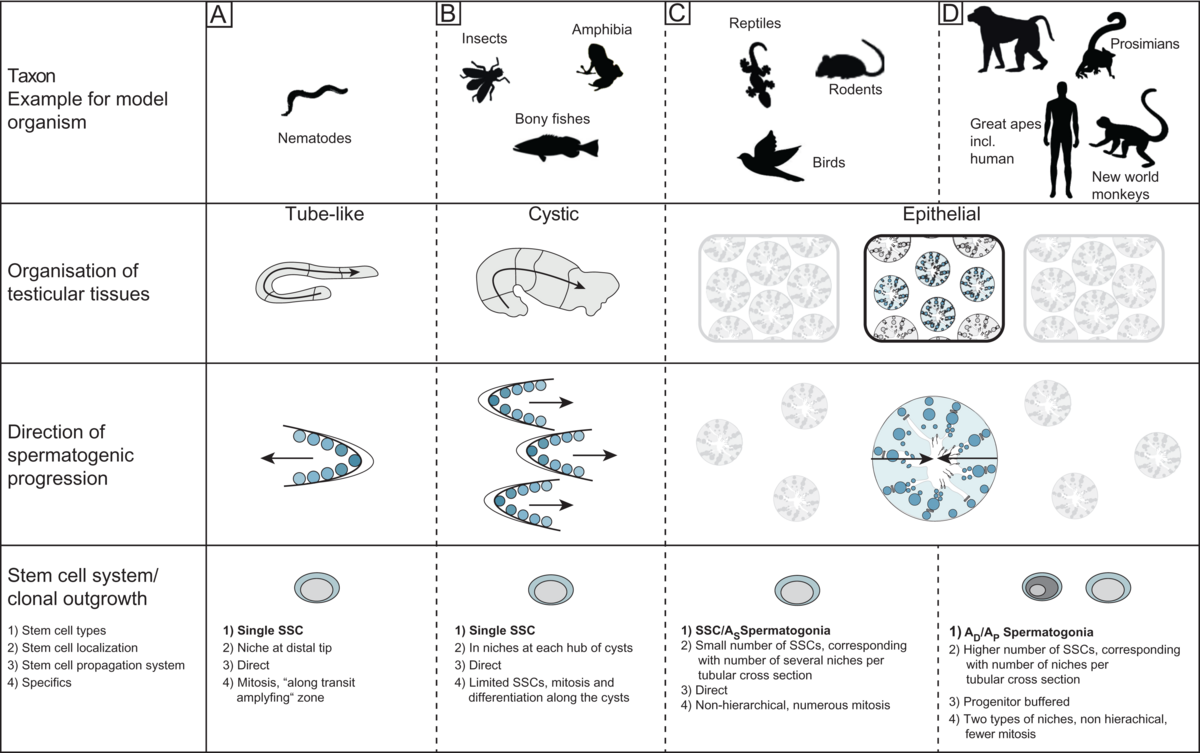
Vergleich von Hodenorganisationsstrukturen in Modellorganismen (Sharma et al. 2019) Wie alle Lebensfunktionen unterliegt männliche Reproduktion evolutiven Herausforderungen. Da letztlich für die Weitergabe des Genoms in die Folgegenerationen verantwortlich, ist die Bildung von „erfolgreichen“ Gameten während der Spermatogenese durch zahlreiche Faktoren beeinflusst. Unter diesen sind insbesondere zwei relevant, die Spermienkompetition auf der einen und die spermatogonialen Stammzellsysteme auf der anderen Seite ab (Zusammenfassung bei Ramm et al. 2014, Sharma et al. 2019). Wir befassen uns daher mit der Frage, wie sich Spermienkompetition im Hoden von Primaten und Vögeln abbildet und konnten zeigen, dass in diesen Taxa völlig unterschiedliche Adaptationen auf diese Herausforderung entstanden sind. Während sich bei Primaten kompetitive Verhältnisse tatsächlich nur in der relativen Hodengröße spiegeln (Wistuba et al. 2003, Luetjens et al. 2005), haben Vögel, deren Hoden im Körper liegen, das Verhältnis von seminiferem zu interstitiellem Gewebe angepasst und unterschiedliche Spermienlängen hervorgebracht (Luepold et al. 2011). Erste Daten deuten zudem an, dass auch die Zykluslänge, also die Dauer zur Produktion reifer Gameten variabel ist (Bennison, unpubl.). Interessanterweise ergab die vergleichende Betrachtung der Organisation des Hodengewebes sowie der endokrinen Regulation der männlichen Reproduktion von Primaten weitere bis dahin unbekannte Befunde. So entspricht Hodengewebe von Neuweltaffen auf zellulärer Ebene und bezüglich der Entwicklungsabläufe dem der Menschenaffen (inklusive des Menschen), unterscheidet sich jedoch von dem der Halb- und Altweltaffen. Diese konvergente Erscheinung ist wahrscheinlich auf eine bestimmte Klongröße und Synchronie der spermatogonialen Stammzellen zurückzuführen. Dafür unterscheidet sich jedoch das reproduktive Endokrinum bei Neuweltaffen erheblich, da das Luteinisierende Hormon fehlt und auch der Rezeptor mutiert ist, hier stehen die Altweltaffen dem Menschen näher, die über ein identisches LH/CG – LH-Rezeptor System verfügen (Wistuba et al. 2003, Gromoll et al. 2003). Damit sind Neuweltaffen modellhaft für Forschungen zu zellulären Komposition und zur Entwicklung des Hodens, Altweltaffen jedoch zur Untersuchung der hormonellen Regulation anzusehen. Diese Erkenntnisse sind für die andrologische Forschung von erheblicher Bedeutung, da in diesem Gebiet tierexperimentell Studien nach wie vor – aufgrund der Besonderheiten des spermatogonialen Stammzellsystems – mit Primaten geführt werden, auch wenn mit Nachdruck an Ersatzmethoden gearbeitet wird (Sharma et al. 2019).
Neben der Aufgabe maximaler Produktion müssen in der Keimbahn auch Mechanismen zum Schutz erfolgreicher Genome sowie eine Anpassung an kurze oder lange reproduktive Lebensperioden entwickelt sein. Während sich beispielsweise eine Maus in der Regel nur zwei Vegetationsphasen lang vermehrt, sind etwa Affen über viele Jahre fertil, was mit einem erhöhten Risiko für Verletzungen oder infektiöse Ereignisse einhergeht. Das heißt, dass die Aufgabe der Bereitstellung einer möglichst großen Anzahl fertiler Gameten gegen den Erhalt einer langlebigen Keimbahn zu balancieren ist. Eine der Anpassungen, die wir in diesem Zusammenhang intensiv betrachten, sind daher unterschiedliche Stammzellsysteme. Während etwa Nager über ein direktes System spermatogonialer Stammzellen verfügen, haben Primaten ein sogenanntes progenitor-gepuffertes Stammzellsystem, d.h. es liegen Reserve-Stammzellen vor, die im Falle von Störungen aktiviert werden und die Spermatogenese restaurieren können (Ehmcke et al. 2006, Wistuba et al. 2007, Ramm et al. 2014, Sharma et al 2019).Literatur:
Ehmcke J, Hübner K, Schöler HR, Schlatt S. Spermatogonia: origin, physiology and prospects for conservation and manipulation of the male germ line. Reprod Fertil Dev. 2006;18(1-2):7-12. doi.org/10.1071/rd05119Gromoll J, Wistuba J, Terwort N, Godmann M, Müller T, Simoni M. A new subclass of the luteinizing hormone/chorionic gonadotropin receptor lacking exon 10 messenger RNA in the New World monkey (Platyrrhini) lineage. Biol Reprod. 2003 Jul;69(1):75-80. doi.org/10.1095/biolreprod.102.014902
Luetjens CM, Weinbauer GF, Wistuba J. Primate spermatogenesis: new insights into comparative testicular organisation, spermatogenic efficiency and endocrine control. Biol Rev Camb Philos Soc. 2005 Aug;80(3):475-88. doi.org/10.1017/s1464793105006755
Lüpold S, Wistuba J, Damm OS, Rivers JW, Birkhead TR. Sperm competition leads to functional adaptations in avian testes to maximize sperm quantity and quality. Reproduction. 2011 May;141(5):595-605. doi.org/10.1530/REP-10-0501
Ramm SA, Schärer L, Ehmcke J, Wistuba J. Sperm competition and the evolution of spermatogenesis. Mol Hum Reprod. 2014 Dec;20(12):1169-79. doi.org/10.1093/molehr/gau070
Sharma S, Wistuba J, Pock T, Schlatt S, Neuhaus N. Spermatogonial stem cells: updates from specification to clinical relevance. Hum Reprod Update. 2019 May 1;25(3):275-297. doi.org/10.1093/humupd/dmz006
Wistuba J, Völker W, Ehmcke J, Clemen G. Characterization of glycosaminoglycans during tooth development and mineralization in the axolotl, Ambystoma mexicanum. Tissue Cell. 2003 Oct;35(5):353-61. doi.org/10.1016/s0040-8166(03)00056-9
Wistuba J, Mittag J, Luetjens CM, Cooper TG, Yeung CH, Nieschlag E, Bauer K. Male congenital hypothyroid Pax8-/- mice are infertile despite adequate treatment with thyroid hormone. J Endocrinol. 2007 Jan;192(1):99-109. doi.org/10.1677/JOE-06-0054
Experimentelle Ansätze zur translationalen andrologischen Forschung
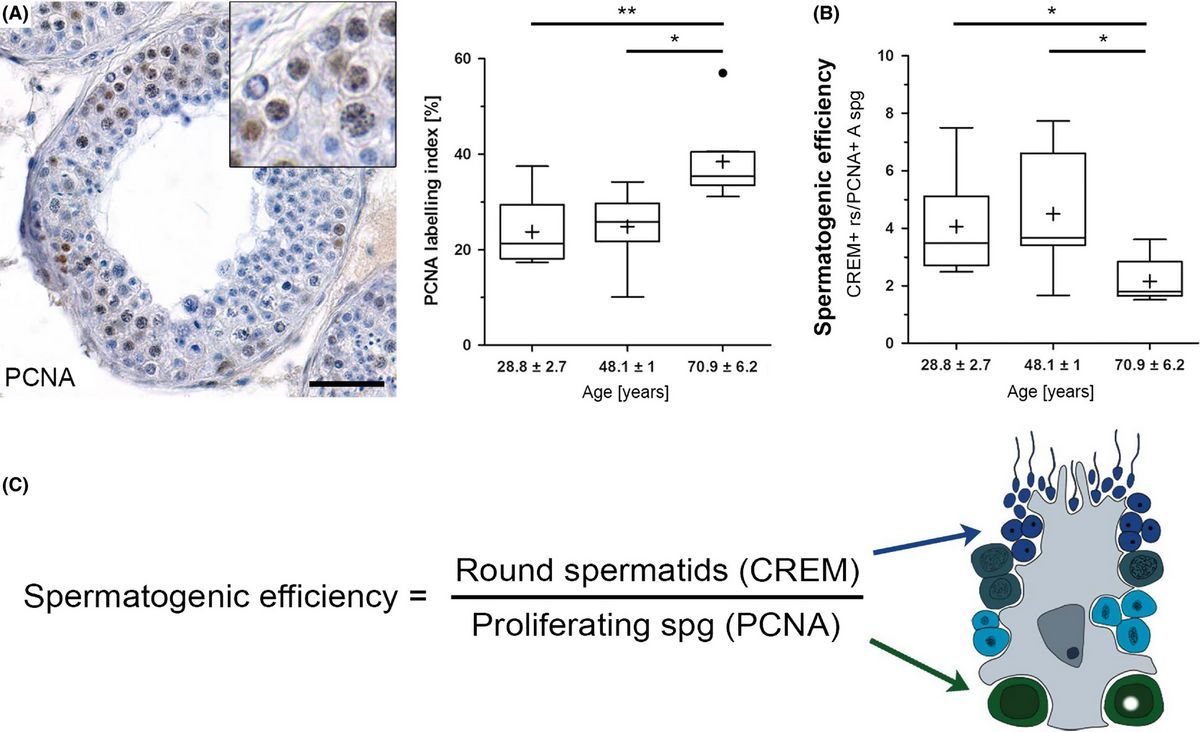
In älteren Männern mit normaler Spermatogenese ist die Proliferation der Spermatogonien erhöht und die Effizienz der Spermatogenese verringert. (A) Immunhistochemische Färbung. (B, C) Effizienz der Spermatogenese und ihre Berechnung. (Pohl et al. 2019) Ein Kernthema der Erforschung männlichen Reproduktion ist die männliche Fertilität/Infertilität. Die Forschung hat dabei in den vergangenen Jahrzehnten insbesondere die Untersuchung von Pathophysiologien, die Infertilität bewirken, sowie Optionen zur Bereitstellung einer zuverlässigen männlichen Kontrazeptionsmethode in den Fokus gestellt. Zum Verständnis der Physiologie beider Aspekte und um dieses ggfs. experimentell zu adressieren, sind translationale Ansätze notwendig.
Neben Modellen, die zur Klärung der Ursachen von Infertilität beitragen, haben wir auch ein weiteres wichtiges Thema der Andrologie in tierexperimentellen Studien adressiert, nämlich Wege zur Bereitstellung einer zuverlässigen männlichen Kontrazeption auf hormoneller Basis, die im Gegensatz zur weiblichen Verhütung bis heute fehlt. Wir haben diese Untersuchungen insbesondere vor dem Hintergrund durchgeführt, die eingesetzten Substanzen (Testosteronester und Gestagene) in ihrer Wirkung bei den für diese Studien notwendigen „nicht-humanen Primaten“, Marmosetten und Makaken (Nagerstudien sind nicht oder nur eingeschränkt übertragbar, s.o), zu charakterisieren (Wistuba et al. 2005, 2012, Junaidi et al. 2005) und die Versuchstiere hinsichtlich ihrer grundsätzlichen Eignung für solche Studien zu definieren (Chandolia et al. 2006, Albert et al. 2010, Irfan et al. 2016). Hierbei war ein ganz wesentlicher Befund, dass Neuweltaffen aufgrund ihrer spezifischen endokrinen Regulation der Reproduktion für Studien zur hormonellen Kontrazeption ungeeignet erscheinen und nicht weiterverwendet werden sollten, da die Steroide wahrscheinlich stärker auf das Sozialverhalten einwirken, als auf die Fertilität (Wistuba et al. 2013, Irfan et al. 2016).
Der Erhalt der männlichen Keimbahn durch Transplantation von Keimzellen oder Hodengewebsfragmenten ist ebenfalls ein Schwerpunkt unserer Forschung. Neben der Möglichkeit die Hodenfunktionen unter derartiger experimenteller Manipulation besser zu verstehen, bieten die Methoden der Keimbahntransplantation auch Anwendungsbezüge: Ursprünglich als Methode zur Herstellung von Transgenese (Wistuba & Schlatt 2002, Wistuba et al. 2007), später auch zum Fertilitätserhalt in malignen Kindspatienten entwickelt (s. u.), wird sie inzwischen auch als Option zur Erhaltung der Keimbahnen bedrohter (Säuger)arten diskutiert. Wir haben in diesem Zusammenhang einige xenologe und autologe Transplantationsstudien unternommen, in denen wir zeigen konnten, dass die Übertragung von an Nagern gewonnen Ergebnissen auf Primaten (und damit den Menschen) nicht ohne weiteres möglich ist (Wistuba et al. 2004, 2006, Luetjens et al. 2008, Ntemou et al. 2019). Unsere translationalen, tierexperimentellen Ansätze in der andrologischen Forschung haben immer das übergeordnete Ziel verfolgt, die von uns gefundenen spezifischen Bedingungen verschiedener Spermatogeneseformen (s.o.) dahingehend umzusetzen, sinnvolle tierexperimentelle Studien für den Erkenntnistransfer in eventuelle klinische Anwendungen und das jeweils beste Tiermodell für die jeweilige Fragestellung vorschlagen - oder vice versa ausschließen zu können.
Derzeit wird die Auswirkung des paternalen Alters auf pathologische Veränderungen der Nachkommen intensiv diskutiert (Pohl et al. 2016, 2019). Wir verfolgen diese Fragestellung in einer cross-sectionalen/longitudinalen Studie mittels unserer Makakenkolonie, in der wir die Reproduktionsparameter der männlichen Tiere zunächst über 5 Jahre verfolgen. Aus diesem kontrollierten tierexperimentellen Setting erhoffen wir uns einen Datensatz, der sich präklinisch extrapolieren lassen sollte.Literatur:
Albert S, Ehmcke J, Wistuba J, Eildermann K, Behr R, Schlatt S, Gromoll J. Germ cell dynamics in the testis of the postnatal common marmoset monkey (Callithrix jacchus). Reproduction. 2010 Nov;140(5):733-42. doi.org/10.1530/REP-10-0235
Chandolia RK, Luetjens CM, Wistuba J, Yeung CH, Nieschlag E, Simoni M. Changes in endocrine profile and reproductive organs during puberty in the male marmoset monkey (Callithrix jacchus). Reproduction. 2006 Aug;132(2):355-63. doi.org/10.1530/rep.1.01186
Irfan S, Ehmcke J, Shahab M, Wistuba J, Schlatt S. Immunocytochemical localization of kisspeptin and kisspeptin receptor in the primate testis. J Med Primatol. 2016 Jun;45(3):105-11. doi.org/10.1111/jmp.12212
Junaidi A, Luetjens CM, Wistuba J, Kamischke A, Yeung CH, Simoni M, Nieschlag E. Norethisterone enanthate has neither a direct effect on the testis nor on the epididymis: a study in adult male cynomolgus monkeys (Macaca fascicularis). Eur J Endocrinol. 2005 Apr;152(4):655-61. doi.org/10.1530/eje.1.01878
Luetjens CM, Stukenborg JB, Nieschlag E, Simoni M, Wistuba J. Complete spermatogenesis in orthotopic but not in ectopic transplants of autologously grafted marmoset testicular tissue. Endocrinology. 2008 Apr;149(4):1736-47. doi.org/10.1210/en.2007-1325
Ntemou E, Kadam P, Van Saen D, Wistuba J, Mitchell RT, Schlatt S, Goossens E. Complete spermatogenesis in intratesticular testis tissue xenotransplants from immature non-human primate. Hum Reprod. 2019 Mar 1;34(3):403-413. doi.org/10.1093/humrep/dey373
Pohl E, Gromoll J, Kliesch S, Wistuba J. An alternative interpretation of cellular 'selfish spermatogonial selection'-clusters in the human testis indicates the need for 3-D-analyses. Andrology. 2016 Mar;4(2):213-7. doi.org/10.1111/andr.12142
Pohl E, Höffken V, Schlatt S, Kliesch S, Gromoll J, Wistuba J. Ageing in men with normal spermatogenesis alters spermatogonial dynamics and nuclear morphology in Sertoli cells. Andrology. 2019 Nov;7(6):827-839. doi.org/10.1111/andr.12665
Wistuba J, Schlatt S. Transgenic mouse models and germ cell transplantation: two excellent tools for the analysis of genes regulating male fertility. Mol Genet Metab. 2002 Sep-Oct;77(1-2):61-7. doi.org/10.1016/s1096-7192(02)00142-7Wistuba J, Mundry M, Luetjens CM, Schlatt S. Cografting of hamster (Phodopus sungorus) and marmoset (Callithrix jacchus) testicular tissues into nude mice does not overcome blockade of early spermatogenic differentiation in primate grafts. Biol Reprod. 2004 Dec;71(6):2087-91. doi.org/10.1095/biolreprod.104.033431
Wistuba J, Marc Luetjens C, Kamischke A, Gu YQ, Schlatt S, Simoni M, Nieschlag E. Pharmacokinetics and pharmacodynamics of injectable testosterone undecanoate in castrated cynomolgus monkeys (Macaca fascicularis) are independent of different oil vehicles. J Med Primatol. 2005 Aug;34(4):178-87. doi.org/10.1111/j.1600-0684.2005.00115.x
Wistuba J, Mittag J, Luetjens CM, Cooper TG, Yeung CH, Nieschlag E, Bauer K. Male congenital hypothyroid Pax8-/- mice are infertile despite adequate treatment with thyroid hormone. J Endocrinol. 2007 Jan;192(1):99-109. doi.org/10.1677/JOE-06-0054
Wistuba J, Nieschlag E, Semjonow A, Sandhowe-Klaverkamp R, Friderichs-Gromoll S, Zitzmann M, Simoni M, Luetjens CM. Testosterone-induced prostate growth is blocked by co- and pre-administration of norethisterone enanthate (NETE) in castrated cynomolgous monkeys (Macaca fascicularis). Urologia Internationalis 2012; 88: 358-364; IF 1,065 doi.org/10.1159/000335209
Wistuba J, Luetjens CM, Ehmcke J, Redmann K, Damm OS, Steinhoff A, Sandhowe-Klaverkamp R, Nieschlag E, Simoni M, Schlatt S. Experimental endocrine manipulation by contraceptive regimen in the male marmoset (Callithrix jacchus). Reproduction. 2013 Apr 15;145(4):439-51. doi.org/10.1530/REP-12-0373
In vitro Differenzierung der männlichen Keimbahn – Gametenreifung in der Petrischale
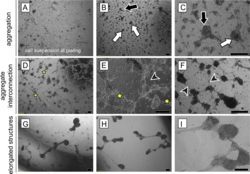
Morphologische Unterschiede in adulten Hodenzellen aus in vitro Suspensionskulturen. Die Serie von repräsentative Phasenkontrastbildern zeigt die typischen Veränderungen in Zellverbünden. (A) Die frisch präparierte Zellsuspension besteht aus einzelnen Zellen und kleinen mehrzelligen Zellaggregaten. (B, C) Nach zweitägiger Kultivierung (definiert als Tag 0) haben sich die Zellen zu unregelmäßigen (schwarze Pfeile) und/oder runden Aggegaten (weiße Pfeile) zusammen gefunden. (D-F) Tag 1: Aggregate bilden untereinander Verbindungen durch Bündel von lang gestreckten Zellen (Stern). Zusätzlich ragen einzelne lang gestreckte Zellen aus den Aggregaten heraus (schwarzer Pfeilkopf). (G-I) Tag 3: Aggregate werden kompakter und benachbarte Aggregate verbinden sich um längliche Strukturen zu bilden. Maßstab 200 µm. © Mincheva et al. 2018 Die Weitergabe des Genoms in die nachfolgende Generation hat eine zentrale biologische Bedeutung für den Organismus, die Untersuchung der Differenzierung männlicher Keimzellen zu Spermien ist daher immer ein zentrales Thema biologischer Forschung gewesen. Spermatogenese ist jedoch ein äußerst komplexer Vorgang. Seit über einem Jahrhundert wird versucht, diese Ausreifung von Samenzellen in Zell- und Organkulturen nachzuvollziehen, um die Kooperation und Kommunikation zwischen den somatischen Zellen des Hodens und der Keimbahn zu verstehen (Reuter et al. 2012) und den Prozess der Haploidisierung in vitro möglichst vollständig nachzuvollziehen. Trotz jahrzehntelanger Forschung sind diese Ansätze weitgehend experimentell geblieben. In den letzten Jahren konnten jedoch durch Verwendung neuer Kultursysteme wichtige Prinzipien entdeckt werden, die geeignet sein können, Säugetierspermien in vitro zu differenzieren. Obwohl hinsichtlich der Effizienz limitiert, konnten mit Spermien aus Gewebekulturen kürzlich erstmals auf assistiertem Weg lebende Mäuse generiert werden. In Kulturen mit Gemischen isolierter testikulärer Mauszellen konnten wir nach einigen Wochen morphologisch ausdifferenzierte Spermatozoen erhalten, nachdem zuvor nur diploide prämeiotische Zellen in Kultur genommen worden waren. Hierzu haben wir neuartige matrixbasierte, dreidimensionale Kultursysteme verwendet, die auch in der regenerativen Medizin Anwendung finden (Soft Agar Culture System (SACS), Methylcellulose Culture System (MCS), Stukenborg et al., 2008, 2009, Reuter et al. 2012).
Zentrale Befunde dieser Studien waren, dass die Differenzierung von murinen Keimzellen in Kultur zwingende Voraussetzungen hat, nämlich eine räumliche Orientierung der Zellen zu ermöglichen, sowie die Co-Kultivierung der somatischen testikulären Zellen. In wie weit zudem eine Zugabe von Hormonen der reproduktiven Achse notwendig ist, ist noch nicht eindeutig geklärt. Vor der dem Hintergrund dieser Befunde untersuchen wir derzeit die Verwendung von kollagenen Schwämmchen als Kultursubstrat, da deren Porosität und ihre Zusammensetzung aus Bestandteilen, die auch Teil der natürlichen extrazellulären Matrix sind, sie als ein geeignetes Substrat für die Rekonstruktion der zellulären Zusammenhänge im Hoden erscheinen lassen (Reuter et al. 2014). Geplant ist zudem, diese Systeme auch auf Primaten und schließlich auf den Menschen zu übertragen. Letzteres ist vor dem Hintergrund der unterschiedlichen Stammzellsysteme im Hoden besonders relevant. Die geschilderten Fortschritte bei der Kultur testikulärer Zellen eröffnen zudem eine Option manipulierbare in vitro Systeme zu entwickeln, die dazu beitragen können die zentralen Prozesse der Spermatogenese besser zu verstehen.
Sie können aber auch klinische Relevanz erreichen, wenn es gelingt, undifferenzierte menschliche Keimzellen in vitro auszureifen um sie einzulagern und im Kindesalter erkrankten Jungen als Fertilitätsreserve zur Verfügung zu stellen, fehlt doch derzeit eine solche Option für Kinder die sich einer Chemotherapie oder Radiatio unterziehen müssen, wenn sie maligne erkrankt sind. Solche Patienten gesunden häufig, sind aber als Nebenwirkung der Therapie infertil. In unseren derzeit aktuellen Projekten testen wir inzwischen menschliche Gewebe und testikuläre Zellen um ein homologes System zur in vitro Differenzierung der männlichen Keimbahn bereitzustellen (Mincheva et al. 2018, 2019).Literatur:
Mincheva M, Sandhowe-Klaverkamp R, Wistuba J, Redmann K, Stukenborg JB, Kliesch S, Schlatt S. Reassembly of adult human testicular cells: can testis cord-like structures be created in vitro? Mol Hum Reprod. 2018 Feb 1;24(2):55-63. doi.org/10.1093/molehr/gax063
Mincheva M, Sandhowe-Klaverkamp R, Wistuba J, Redmann K, Stukenborg JB, Kliesch S, Schlatt S. Reassembly of adult human testicular cells: can testis cord-like structures be created in vitro? Mol Hum Reprod. 2018 Feb 1;24(2):55-63. doi.org/10.1093/molehr/gax063
Reuter K, Schlatt S, Ehmcke J, Wistuba J. Fact or fiction: In vitro spermatogenesis. Spermatogenesis. 2012 Oct 1;2(4):245-252. doi.org/10.4161/spmg.21983
Reuter K, Ehmcke J, Stukenborg JB, Simoni M, Damm OS, Redmann K, Schlatt S, Wistuba J. Reassembly of somatic cells and testicular organogenesis in vitro. Tissue Cell. 2014 Feb;46(1):86-96. doi.org/10.1016/j.tice.2013.12.001
Stukenborg JB, Wistuba J, Luetjens CM, Elhija MA, Huleihel M, Lunenfeld E, Gromoll J, Nieschlag E, Schlatt S. Coculture of spermatogonia with somatic cells in a novel three-dimensional soft-agar-culture-system. J Androl. 2008 May-Jun;29(3):312-29. doi.org/10.2164/jandrol.107.002857
Stukenborg JB, Schlatt S, Simoni M, Yeung CH, Elhija MA, Luetjens CM, Huleihel M, Wistuba J. New horizons for in vitro spermatogenesis? An update on novel three-dimensional culture systems as tools for meiotic and post-meiotic differentiation of testicular germ cells. Mol Hum Reprod. 2009 Sep;15(9):521-9. doi.org/10.1093/molehr/gap052
Klinefelter Syndrom als Beispiel für die Konsequenzen einer gestörten geschlechtschromosomalen Balance: das 41, XXY* Mausmodel
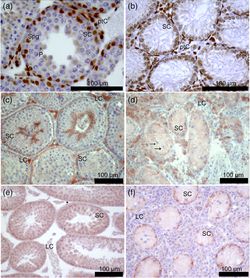
Immunhistochemische Detektion des Androgen-Rezeptors (AR) sowie von occulin und ZO-1 in Schnitten von Mäusehoden. (a, c, e) 40, XY* Kontrolle; (b, d, f) 41, XXY* Gewebe; (a, b, e, f) 21 Tage post partum; (c, d) adult. Das Klinefelter Syndrom (KS: sex-chromosomale Aberration, Karyotyp 47,XXY) ist mit einer Inzidenz von ca. 1:600 eine der wichtigsten komplex-genetischen Erkrankungen bei Männern und steht exemplarische für die Auswirkungen einer gestörten sexchromosomalen Balance. Diese entsteht durch eine Fehlverteilung der Geschlechtschromosomen bei der Gametenbildung der Elterngeneration. Der Karyotyp 47, XXY ist die häufigste genetische Ursache männlicher Infertilität, denn das überzählige X-Chromosom provoziert den - bis zum Erreichen der Pubertät zumeist vollständigen -Verlust der Keimzellen, ist aber eben keine letale Trisomie. Weiterhin ist generell ein veränderter endokriner Phänotyp zu beobachten, der hypergonadotrope Hypogonadismus; gekennzeichnet durch erhöhte Werte für Follikelstimulierendes und Luteinisierendes Hormon bei erniedrigten Testosteronspiegeln. Daneben treten bei Klinefelter Patienten heterogen eine Vielzahl weiterer phänotypischer Änderungen auf, die teils erhebliche metabolische, kognitive und kardiovaskuläre Folgen für die Patienten haben (Zitzmann et al. 2015, Brand et al. 2018, Wistuba et al. 2017) Die exemplarische Untersuchung des KS kann daher – neben der klinischen Relevanz für verbesserte Therapieoptionen für die betroffenen Patienten – auch zum verbesserten Verständnis genereller Mechanismen, die mit gestörten Gendosiseffekten einhergehen, beitragen. Die Untersuchung von molekularen Prozessen, die durch die gestörte chromosomale Balance ausgelöst werden, ist jedoch in klinischen Studien nur sehr eingeschränkt durchführbar. Zur translationalen Untersuchung der mit dem KS verbundenen molekularen Mechanismen ermöglicht die Verfügbarkeit einer Mauslinie mit dem Karyotyp 41,XXY*, einen einzigartigen experimentellen Zugang zu funktionellen Studien. So konnten wir in den vergangenen Jahren zeigen, dass die Inaktivierung des zweiten X-Chromosoms der im weiblichen Geschlecht vorliegenden vergleichbar ist und daraus ableiten, dass nur solche Gene für die beobachteten phänotypischen Veränderungen verantwortlich sein können, die dieser Inaktivierung entkommen. Solche „escapee“ Gene sind zudem auch noch gewebespezifisch in unterschiedlichen Mustern exprimiert. Der Keimzellverlust wird bereits viel früher manifest als bisher angenommen und scheint in der Störung der Keimbahnstammzellen zu gründen, die steroidogenen Leydigzellen hingegen sind nicht wie ursprünglich angenommen funktionell reduziert sondern im Gegenteil kompensatorisch hyperaktiviert, was die Hypothese aufgeworfen hat, dass die hypogonadalen Testosteronwerte weniger in einer sekretorischen als vielmehr in einer Störung des Hormontransportes zu suchen sind (Wistuba 2010, Wistuba et al. 2013, Wistuba et al. 2020a). Dieser Frage gehen wir aktuell nach und konnte bereits zeigen, dass die testikuläre Gefäßversorgung tatsächlich eingeschränkt ist (Tüttelmann et al. 2014, Wistuba et al. 2020b), was auch mit der Verarmung und dem späteren Ausfall der spermatogonialen Stammzellen zusammenhängen könnte, da deren Einnischung gefäßabhängig erfolgt.
Die von uns entwickelten Ansätze sind sämtlich in klinische Untersuchungen eingeflossen und haben gezeigt, dass die Untersuchung des Mausmodells relevante Rückschlüsse auf die menschliche Erkrankung zulässt und somit das Verständnis des Syndroms als auch die Entwicklung neuer Therapien unterstützen kann. Die tierexperimentellen Arbeiten zum KS wurden bisher durch ein fakultätsgefördertes Projekt (Innovative Medizinische Forschung (IMF LU 1 2 03 05) der Medizinischen Fakultät der WWU) sowie in zwei durch die DFG unterstützten Sachbeihilfen (DFG WI 2723 /1-1; WI 2713/ 4-1) gefördert. Zwei aus den DFG geförderten Projekten hervorgegangene Publikationen wurden 2011 und 2014 mit dem Dietrich-Knorr-Preis der Deutschen Gesellschaft für Endokrinologie ausgezeichnet (Wistuba et al. 2010, Werler et al. 2014).Literatur:
Brand C, Zitzmann M, Eter N, Kliesch S, Wistuba J, Alnawaiseh M, Heiduschka P. Aberrant ocular architecture and function in patients with Klinefelter syndrome. Sci Rep. 2017 Oct 13;7(1):13130. doi.org/10.1038/s41598-017-13528-4Tuttelmann F, Damm OS, Luetjens CM, Baldi M, Zitzmann M, Kliesch S, Nieschlag E, Gromoll J, Wistuba J, Simoni M. Intratesticular testosterone is increased in men with Klinefelter syndrome and may not be released into the bloodstream owing to altered testicular vascularization– a preliminary report. Andrology. 2014 Mar;2(2):275-81. doi.org/10.1111/j.2047-2927.2014.00190.x
Werler S, Demond H, Damm OS, Ehmcke J, Middendorff R, Gromoll J, Wistuba J. Germ cell loss is associated with fading Lin28a expression in a mouse model for Klinefelter's syndrome. Reproduction. 2014 Jan 25;147(3):253-64. doi.org/10.1530/REP-13-0608
Wistuba J. Animal models for Klinefelter's syndrome and their relevance for the clinic. Mol Hum Reprod. 2010 Jun;16(6):375-85. doi.org/10.1093/molehr/gaq024
Wistuba J, Werler S, Lewejohann L. Mouse models for the exploration of Klinefelter´s syndrome. In Conn MJ (ed) Animal models of human diseases, Elsevier, 2013, 759-784, doi.org/10.1016/B978-0-12-809468-6.00024-3
Wistuba J, Werler S, Lewejohann L, Brand C, Damm OS. Mouse models for the exploration of Klinefelter´s syndrome. In Conn MJ (ed) Animal models for the study of human diseases; 2nd revised edition, Elsevier Academic Press, ISBN 9780128094686, published date: 8th June 2017, Page Count: 1182 , 2017, pages 617-645
Wistuba J, Beumer C, Brehm R, Gromoll J. 41,XXY * male mice: An animal model for Klinefelter syndrome. Am J Med Genet C Semin Med Genet. 2020 Jun;184(2):267-278. doi.org/10.1002/ajmg.c.31796
Wistuba J, Beumer C, Warmeling AS, Sandhowe-Klaverkamp R, Stypmann J, Kuhlmann M, Holtmeier R, Damm OS, Tüttelmann F, Gromoll J. Testicular blood supply is altered in the 41,XXY* Klinefelter syndrome mouse model. Sci Rep. 2020 Sep 1;10(1):14369. doi.org/10.1038/s41598-020-71377-0Zitzmann M, Bongers R, Werler S, Bogdanova N, Wistuba J, Kliesch S, Gromoll J, Tüttelmann F. Gene expression patterns in relation to the clinical phenotype in Klinefelter syndrome. J Clin Endocrinol Metab. 2015 Mar;100(3):E518-23. doi.org/10.1210/jc.2014-2780

