Neurobiologie affektiver Störungen: Eine translationale Perspektive auf Hirnstruktur und -funktion

Durchgeführt von: Translationale Psychiatrie
Ehemalige Mitarbeiter: Christian Bürger, Stella Mercedes Fingas, Dr. Katharina Förster, Dr. Hannah Lemke, Lena Waltemate, Dr. Dario Zaremba
In Kooperation mit: Klinik für Psychische Gesundheit des Universitätsklinikums Münster, der LWL Klinik Münster, der PTA Münster, der Universitätsklinik für Psychiatrie und Psychotherapie, Marburg
Laufzeit: seit 2015
Förderung: Deutsche Forschungsgemeinschaft (Gesamtvolumen der FOR2107: 2.987.637 €)
Affektive Störungen, d. h. die Major Depression (MDD) und die Bipolare Störung (BD), sind komplexe und heterogene Erkrankungen. Genetische und umweltbedingte Risikofaktoren tragen zu ihrer Entstehung und möglicherweise auch zu ihrem Verlauf bei und stehen in Wechselwirkung miteinander. Die neurobiologischen Korrelate, über die diese Prädispositionen ihren Einfluss auf die Struktur und Funktion des Gehirns ausüben, sind nur unzureichend bekannt. Die Ziele dieser Forschergruppe sind die Integration klinischer und neurobiologischer Assoziationen von genetischen und umweltbedingten Risikofaktoren und deren Interaktion bei der Ätiologie, dem Beginn und dem Verlauf affektiver Störungen. Spezifische Ziele sind:
- Aufklärung der Folgen (Mensch) bzw. der neurobiologischen Mechanismen (Tier) neuartiger sowie epidemiologisch validierter genetischer und umweltbedingter Risikofaktoren für affektive Störungen, insbesondere auf der Ebene der Gehirnstruktur und -funktion.
- Aufdeckung neurobiologischer Determinanten für den Krankheitsverlauf (Beginn, Rückfall, diagnostische Verschiebungen, z. B. von MDD zu BD, Veränderungen der Gehirnstruktur und -funktion im Laufe der Zeit).
- De-novo-Subgruppenbildung homogener Patientengruppen auf der Grundlage biologischer, kognitiver und psychopathologischer Längsschnittdaten (neue "Biotypen").
Das Endziel besteht darin, neurobiologische Vermittler und Wege zu entschlüsseln, die von individuellen Konfigurationen genetischer und (interagierender) umweltbedingter Risikofaktoren zu klinischen Symptomen und dem Krankheitsverlauf führen. Diese Daten werden in einer großen Humankohorte (N=2500) von Patienten mit affektiven Störungen (MDD und BD), Personen mit genetischem und/oder umweltbedingtem Risiko (d.h. Verwandte ersten Grades und/oder Personen, die Misshandlungen ausgesetzt waren) und Kontrollpersonen (Marburg Affective Cohort Study, [MACS]; WP1, [CP2]) untersucht. Alle Teilnehmer werden einer umfassenden, hochmodernen Tiefenphänotypisierung unterzogen, die eine multimodale strukturelle und funktionelle Neurobildgebung, eine klinische, neuropsychologische und Persönlichkeitscharakterisierung sowie eine gründliche Bewertung von Umweltrisiken (Misshandlung, Lebensereignisse) und Schutzfaktoren (günstiges Umfeld, soziale Unterstützung) umfasst. Biomaterial wie Blut (für genetische, epigenetische, Genexpressions- und Proteinstudien), Haare und Speichel werden in einem zentralen Biobankprojekt (CP1) gelagert. Die Probanden werden auf genetische und epigenetische Marker hin genotypisiert (WP5, CP1). Die MACS-Teilnehmer werden nach 2 Jahren erneut einer Längsschnittuntersuchung unterzogen. Das Human-Cluster umfasst außerdem ein methodisches Arbeitspaket (WP6), in dem statistische Methoden zur Reduktion phänotypischer Daten, zur genomweiten Assoziation von MRT-Daten und zur Qualitätssicherung der Zuverlässigkeit von MRT-Längsschnittdaten entwickelt werden.
Der menschliche Teil wird durch ein Tierprojekt ergänzt, in dem bekannte Risikofaktoren bei Nagetieren experimentell manipuliert werden (WP2). Genetische Risiken werden durch Nagetiermodelle (CACNA1C, NCAN) in Wechselwirkung mit Umweltrisiken (Misshandlung, soziale Isolation) und Schutzfaktoren (förderliche Umgebung, Anreicherung) eingeführt. Diese Variablen werden systematisch manipuliert, und die Ergebnisse werden mit Humandaten mit entsprechenden Risiken verknüpft. Die Tiere werden einer gründlichen phänotypischen Charakterisierung in Bezug auf Kognition, Emotionen und soziale Funktionen unterzogen, parallel zu den beim Menschen untersuchten Variablen. Darüber hinaus werden in einer Reihe innovativer experimenteller Projekte Daten aus dem menschlichen und tierischen Teil miteinander verbunden und integriert, wobei die Rolle von microRNA/ Neuroplastizitätsmarkern (WP3), Entzündungsmarkern (CP1 und WP2) und zellulärem Stress/LTP/Mitochondrienfunktion (WP4) untersucht wird. Entsprechendes Biomaterial von Menschen (WP1) und Tieren (WP2) wird parallel in WP3 und WP4 analysiert und in WP6 integriert.
Diese DFG-Forschergruppe stellt die größte bildgebende Stichprobe von Patienten mit affektiven Störungen ihrer Art zur Verfügung, mit neuartigen Möglichkeiten zur Untersuchung von Gen-Umwelt-Interaktionen auf verschiedenen Ebenen der Pathologie und der Gehirnfunktion im Zeitverlauf. Sie wird pathophysiologische Entitäten mit gemeinsamen neurobiologischen Grundlagen abgrenzen und den Weg für ein ätiologisches Verständnis affektiver Störungen ebnen, was in Zukunft zu deren Prävention und neuen Therapien führen könnte.
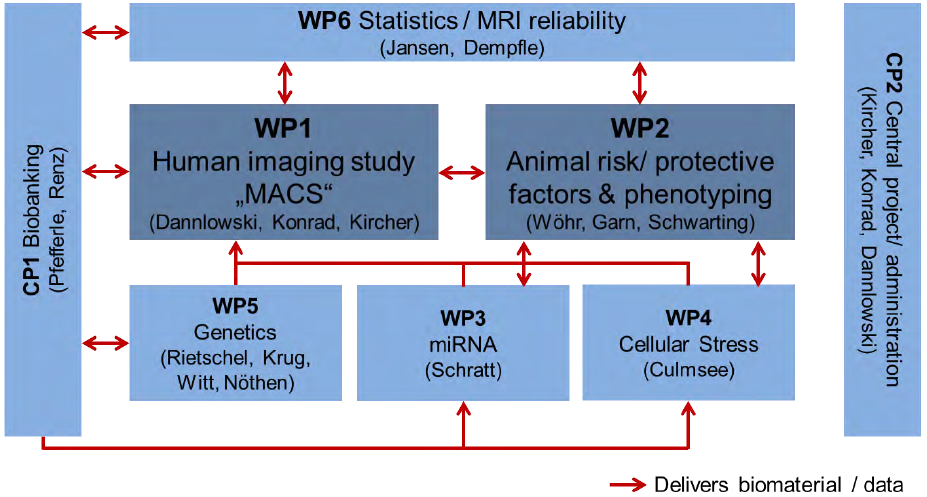
Die FOR2107-Studie wurde mehrfach verlängert im Rahmen der [MACS-Angststörungen], [MACS-Psychosespektrum] und [MACS-5-Jahres-Follow-up].
Wichtigste Veröffentlichungen:
- Patel, Y., Parker, N., Shin, J., Howard, D., French, L., Thomopoulos, S.I. et al. (2021). Virtual Histology of Cortical Thickness and Shared Neurobiology in Six Psychiatric Disorders. JAMA Psychiatry, 78(1), 47-63. DOI: https://doi.org/10.1001/jamapsychiatry.2020.2694pdf
- Brouwer, R.M., Klein, M., Grasby, K.L., Schnack, H.G., Jahanshad, N., Teeuw, J. et al. (2022). Genetic variants associated with longitudinal changes in brain structure across the lifespan. Nature Neuroscience, 25(4), 421-432. DOI: https://doi.org/10.1038/s41593-022-01042-4preprintpdf
- Kroemer, N.B., Opel, N., Teckentrup, V., Li, M., Grotegerd, D., Meinert, S., Lemke, H. et al. (2022). Functional Connectivity of the Nucleus Accumbens and Changes in Appetite in Patients with Depression. JAMA Psychiatry, 79(10), 993-1003.DOI: https://doi.org/10.1001/jamapsychiatry.2022.2464pdf
- Winter, N.R., Leenings, R., Ernsting, J., Sarink, K., Fisch, L., Emden, D. et al. (2022). Quantifying Deviations of Brain Structure and Function in Major Depressive Disorder Across Neuroimaging Modalities. JAMA Psychiatry, 79(9), 879-888. DOI: https://doi.org/10.1001/jamapsychiatry.2022.1780preprintpdf
- Opel, N., Redlich, R., Dohm, K., Zaremba, D., Goltermann, J., Repple, J. et al. (2019). Mediation of the influence of childhood maltreatment on depression relapse by cortical structure: a 2-year longitudinal observational study. The Lancet Psychiatry, 6(4), 318-326. DOI: https://doi.org/10.1016/S2215-0366(19)30044-6 pdf

