News
Was passiert, wenn das „Gummiband“ reißt? Neue Studie vertieft das Wissen zum Muskelprotein Titin
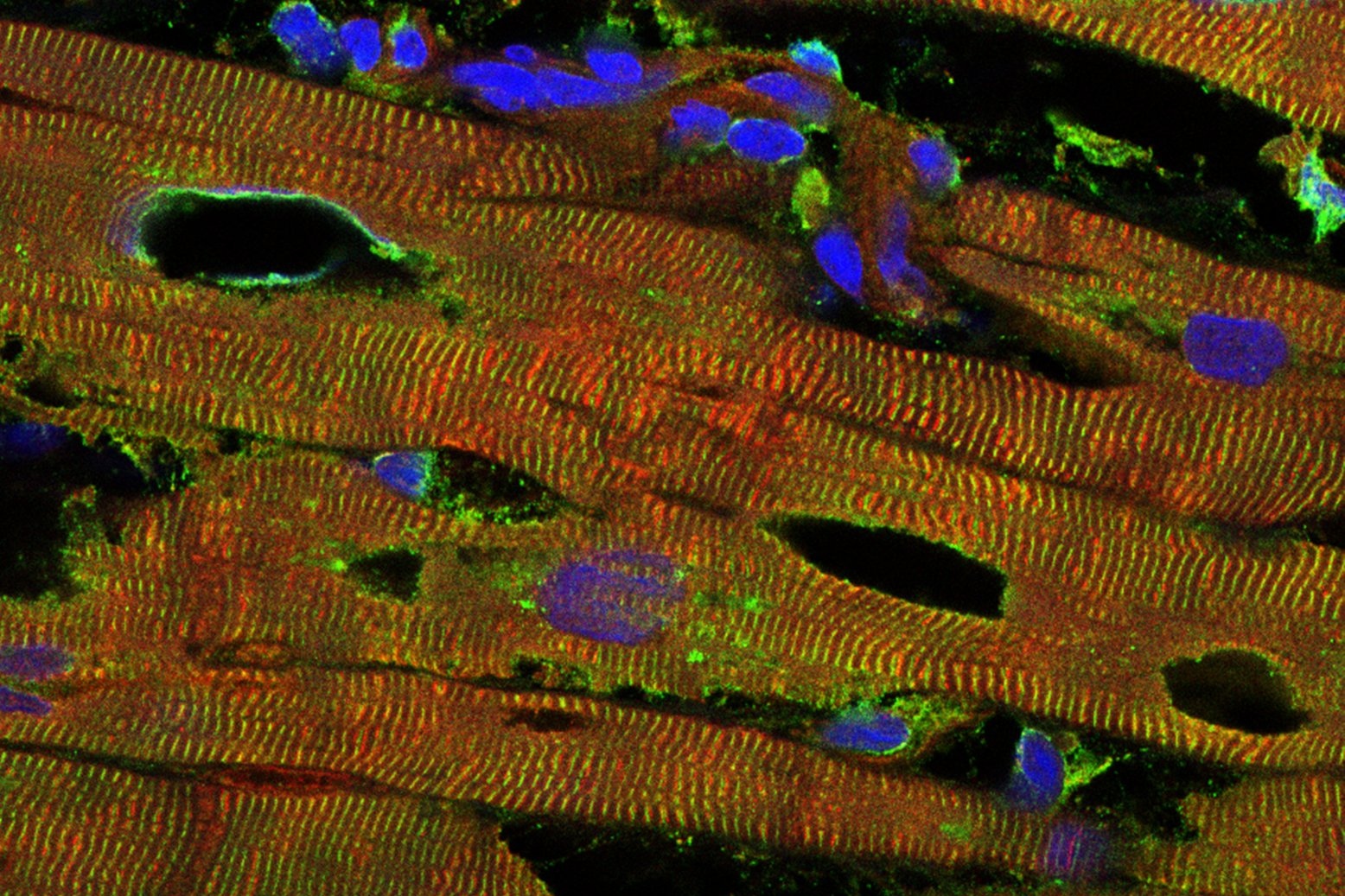
Münster (mfm/lt) – Das Muskelprotein Titin ist das größte bisher bekannte menschliche Protein. Aber vor allem: Es ist maßgeblich daran beteiligt, dass die Fähigkeit zur Bewegung durch stabile und elastische Muskeln gewährleistet wird. Die Forschung hat gezeigt, dass viele Muskel- und Herzerkrankungen auf fehlendes oder mutiertes Titin zurückzuführen sind – allerdings ist die genaue Funktionsweise des Proteins noch nicht ausreichend untersucht. Eine Arbeitsgruppe um Prof. Wolfgang Linke von der Medizinischen Fakultät der Westfälischen Wilhelms-Universität Münster (WWU) konnte nun wesentliche Wissenslücken schließen: Die Forscher entwickelten ein Versuchsmodell, das Aufschluss darüber gibt, was es für den Muskel bedeutet, sich ohne eine funktionsfähige Titinfeder zusammenzuziehen.
Die jetzt in „Elife“, einer Fachzeitschrift für Biomedizin und Biowissenschaften, veröffentlichte Arbeit des Teams erlaubt es, das Muskelprotein Titin in seiner Federregion einfach „durchzuschneiden“ – wie ein Gummiband. „Ein Traum für jemanden wie mich, der sich schon jahrelang mit der Titinforschung befasst“, freut sich Prof. Linke. Möglich wurde der Erfolg durch ein eigens entwickeltes Mausmodell.
Angesichts der Beschaffenheit des Titin-Moleküls ist der Begriff „Schnitt“ im übertragenen Sinne zu verstehen: Tatsächlich erfolgt das Zertrennen durch das Hineinklonen eines winzigen Abschnitts ins Titinmolekül, der von einem bestimmten proteinzersetzenden Enzym, einer so genannten Protease, spezifisch erkannt wird. Die Forscher testeten, wie sich der „Schnitt“ auf die subzelluläre Struktur und die Kraftentwicklung der Muskelfasern auswirkt und fanden heraus, dass die Kontraktionskraft - die Kraft, mit der sich ein Muskel zusammenzieht - um die Hälfte abnimmt, wenn das Titin vollständig durchtrennt wird. Auch konnte die Arbeitsgruppe feststellen, dass die Struktur des Motorproteins Myosin – notwendig für die Erzeugung von Bewegungsvorgängen des Muskels – bei Kontraktion mit zerschnittenen Titinmolekülen teilweise „zerfetzt“ wird.
Die Forschungsgruppe am Institut für Physiologie II der WWU erhofft sich von dem neuen Versuchsmodell Einblicke in das „Lebensschicksal“ der zerschnittenen Titinmoleküle sowie die Antwort auf wichtige Fragen: Was passiert mit mutierten Titin-Molekülen? Werden sie angehäuft und führen sie in der Folge zu Herz- und Muskelerkrankungen? Oder werden sie abgebaut – und falls ja: wie schnell? Ein breiteres Verständnis dieser Prozesse könnte ein Ansatz sein, um Patienten mit Titin-Mutationen erfolgreicher zu behandeln.
Die Arbeit des Teams wurde unter anderem gefördert durch den DFG-Sonderforschungsbereich 1002 sowie durch zwei interne Förderinstrumente der Medizinischen Fakultät, das IZKF Münster und das MedK-Pogramm für herausragende Promotionen.