News
Mutationen im größten menschlichen Protein: WWU-Forschungsgruppe entdeckt wichtige Pathomechanismen bei Herz-Kreislauf-Erkrankung
Die Titin-Forschungsgruppe: Studienleiter Prof. Wolfgang Linke (rechts) und sein Team; bestehend aus Prof. Holger Reinecke, Lina Folsche, Franziska Koser, Andreas Unger, Anna Hucke und Anastasia Hobbach (v.l.n.r). (Foto: privat)
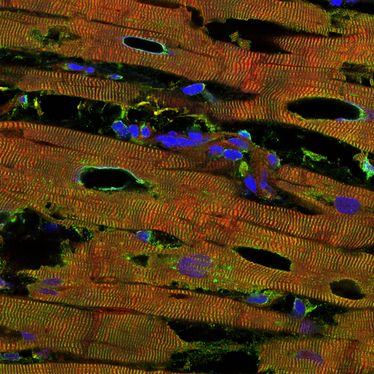
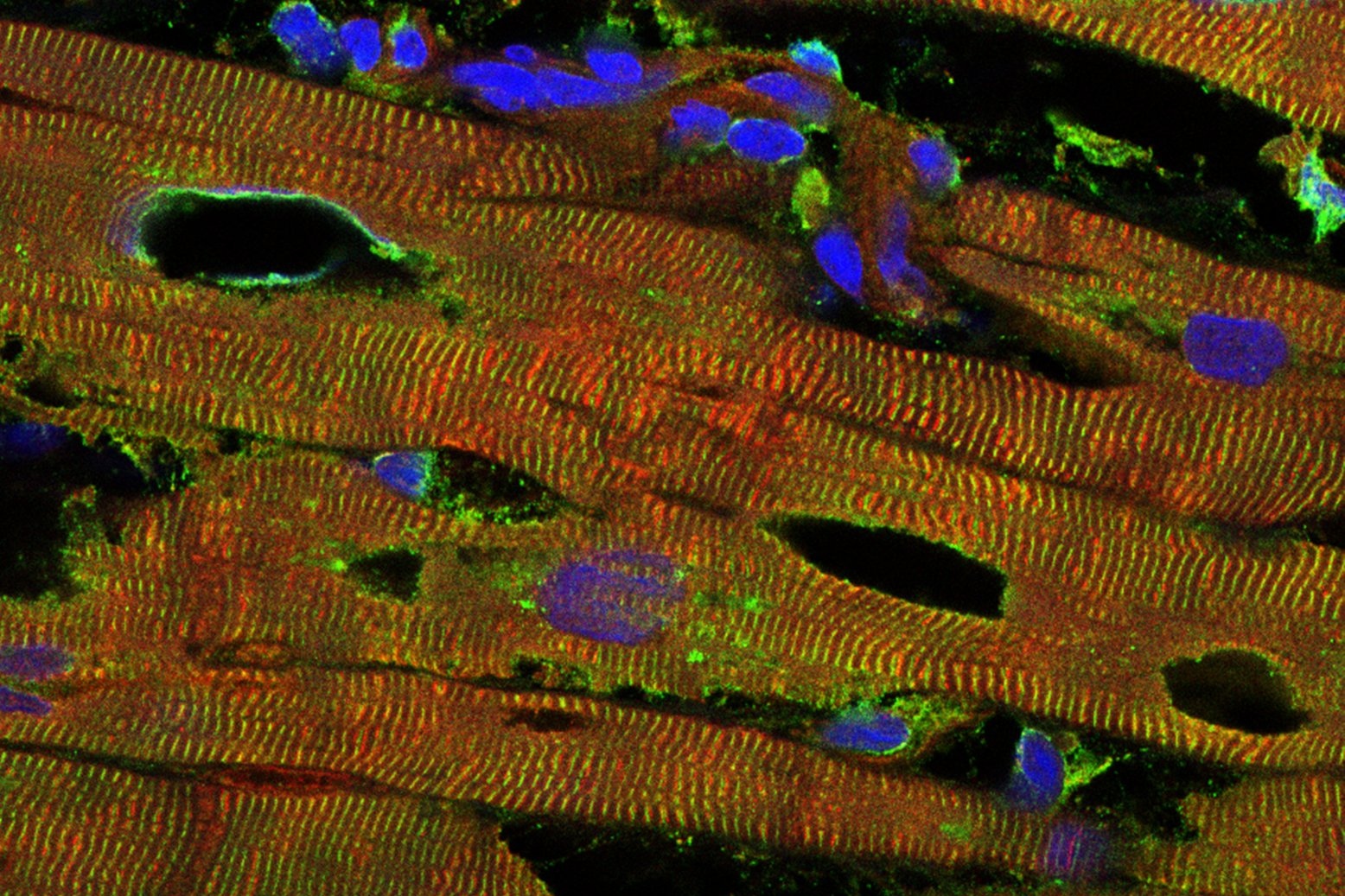
Das Bild zeigt das Herzgewebe einer an der dilatativen Kardiomyopathie erkrankten Person. Die Rotfärbung zeigt Titin, die Grünfärbung einen anderen Marker der kontraktilen Einheiten (Alpha-Aktinin), die Blaufärbung die Zellkerne. Die Löcher deuten auf die beginnende Zerstörung des Gewebes hin (Copyright: AG Linke)
Münster (mfm/sw) – Titin – das „titanisch große“ Protein: Durch das größte Protein des menschlichen Körpers können sich die Muskeln – und damit auch das Herz – elastisch bewegen. Mutationen im Titin-Gen (TTN) können diese Funktion beeinträchtigen und sind damit eine häufige Ursache der Dilatativen Kardiomyopathie, kurz DCM. Das ist eine Erkrankung des Herzmuskels, die zu einer schwachen Pumpfunktion führt. Welche Pathomechanismen dahinter stecken – also warum TTN-Mutationen krankheitsauslösend sind – war bislang unklar. Ein Expertenteam um Prof. Wolfgang Linke, Leiter des Instituts für Physiologie II der Westfälischen Wilhelms-Universität (WWU) Münster hat sich des Themas angenommen – und dabei wegweisende Erkenntnisse gewonnen, die nun in der Fachzeitschrift Science Translational Medicine veröffentlicht wurden.
„Die Ursachen von DCM sind vielfältig – die häufigste ist allerdings ganz klar die TTN-Mutation“, so Projektleiter Linke, „Genau genommen geht es um Verkürzungen im Titin-Gen, sogenannte Trunkationen, kurz TTNtv.“ Die Verkürzung im Molekül betrifft allerdings nur eins der beiden TTN-Allele – also eine Genvariante – das andere Allel ist gesund. Klar ist: Die TTNtv sind seit etwa einem Jahrzehnt als Auslöser der DCM bekannt. Weshalb Patienten mit einem TTNtv-Allel an DCM erkranken, konnte das Team um Prof. Linke nun beantworten.
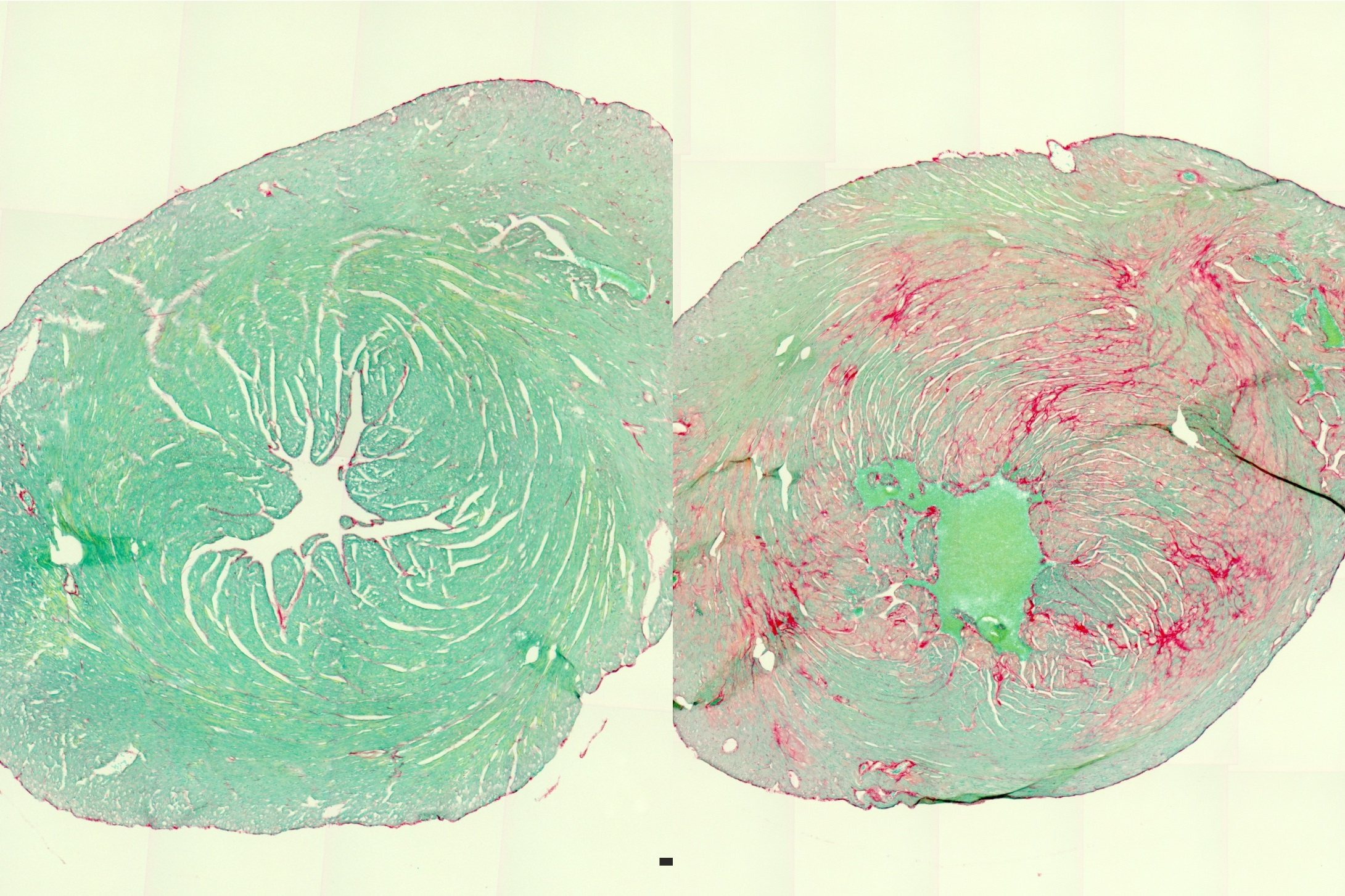
Anhand von über 100 menschlichen Herzgewebsproben entdeckte die Gruppe bislang unerkannte Pathomechanismen: Die TTNtv-DCM-Patienten enthalten in ihren Herzmuskelzellen weniger normales Titin als DCM-Patienten ohne TTNtv und als herzgesunde Menschen. Weniger Titin bedeutet weniger kontraktile – zum Zusammenziehen fähige – Einheiten. Das Resultat ist eine verminderte Kraftentwicklung und ein schwächeres Herz. „Das gesunde Allel produziert zwar normales Titin, kann die Schwäche des verkürzten Allels allerdings nicht kompensieren“, erklärt der Physiologe.
Außerdem beobachtete das Linke-Team erstmals, dass TTNtv-DCM-Patienten trunkierte Titinproteine enthalten. Der Studienleiter erklärt: „Wir zeigen, dass die trunkierten Proteine den Herzmuskelzellen nichts mehr nützen, da sie nicht in die Sarkomere, die kleinsten kontraktilen Einheiten einer Muskelzelle, eingebaut werden“. Stattdessen sammeln sich die trunkierten Proteine in intrazellulären Aggregaten, kleinen Partikeln innerhalb der Zellen. „Ähnlich wie bei neurodegenerativen Erkrankungen wie Alzheimer könnten diese verklumpten Proteine ‚giftig‘ sein.“ Eine weitere Erkenntnis: Die Herzmuskelzellen von TTNtv-DCM-Patienten haben ein Problem mit den intrazellulären Protein-Qualitätskontrollsystemen. Mutierte Proteine werden normalerweise möglichst schnell von Zellen durch intrazelluläre Abbausysteme beseitigt, durch die Produktion von trunkierten Proteinen kommen diese Systeme jedoch durcheinander.
Prof. Linke ist hoch zufrieden: „Unsere Studie ist eine für das Feld wegweisende Arbeit“, so der Titin-Experte. Die Forschungsgruppe konnte nicht nur den Pathomechanismen näher auf den Grund gehen, sondern anhand eines Modellsystems aus menschlichen Zellkulturen auch Vorschläge machen, welche Maßnahmen bei TTNtv-DCM-Patienten für eine erfolgreiche Behandlung oder sogar Heilung der Krankheit ergriffen werden sollten. „Wir zeigen an Zellkulturen, dass die Genschere CRISP/Cas9 die Mutation wieder reparieren kann. Beim Patienten müsste die Genschere an Ort und Stelle ansetzen, also genau an der Herzmuskelzelle. Das ist in dieser Form noch nicht möglich – aber wenn es möglich wird, kann es die Patienten heilen“, erklärt der Projektleiter. Die Studie entstand in enger Zusammenarbeit unter anderem mit der Kardiologie der münsterschen Uniklinik, dem Herz- und Diabeteszentrum Bad Oeynhausen und der Universitätsmedizin in Göttingen, wo Linke eine Gastprofessur innehat. Unterstützt wurde die Arbeit durch zwei Förderlinien der Medizinischen Fakultät Münster (IZKF und MedK), die Deutsche Forschungsgemeinschaft und das Deutsche Zentrum für Herz-Kreislaufforschung.