News
Das "Paper of the Month" 12/2023 geht an: Wolfgang Linke und Christine Loescher aus dem Institut für Physiologie II
Für den Monat Dezember 2023 geht das „Paper of the Month“ der Medizinischen Fakultät der Universität Münster an:
Wolfgang Linke und Christine Loescher aus dem Institut für Physiologie II -Vegetative Physiologie-
für doe Publikation:
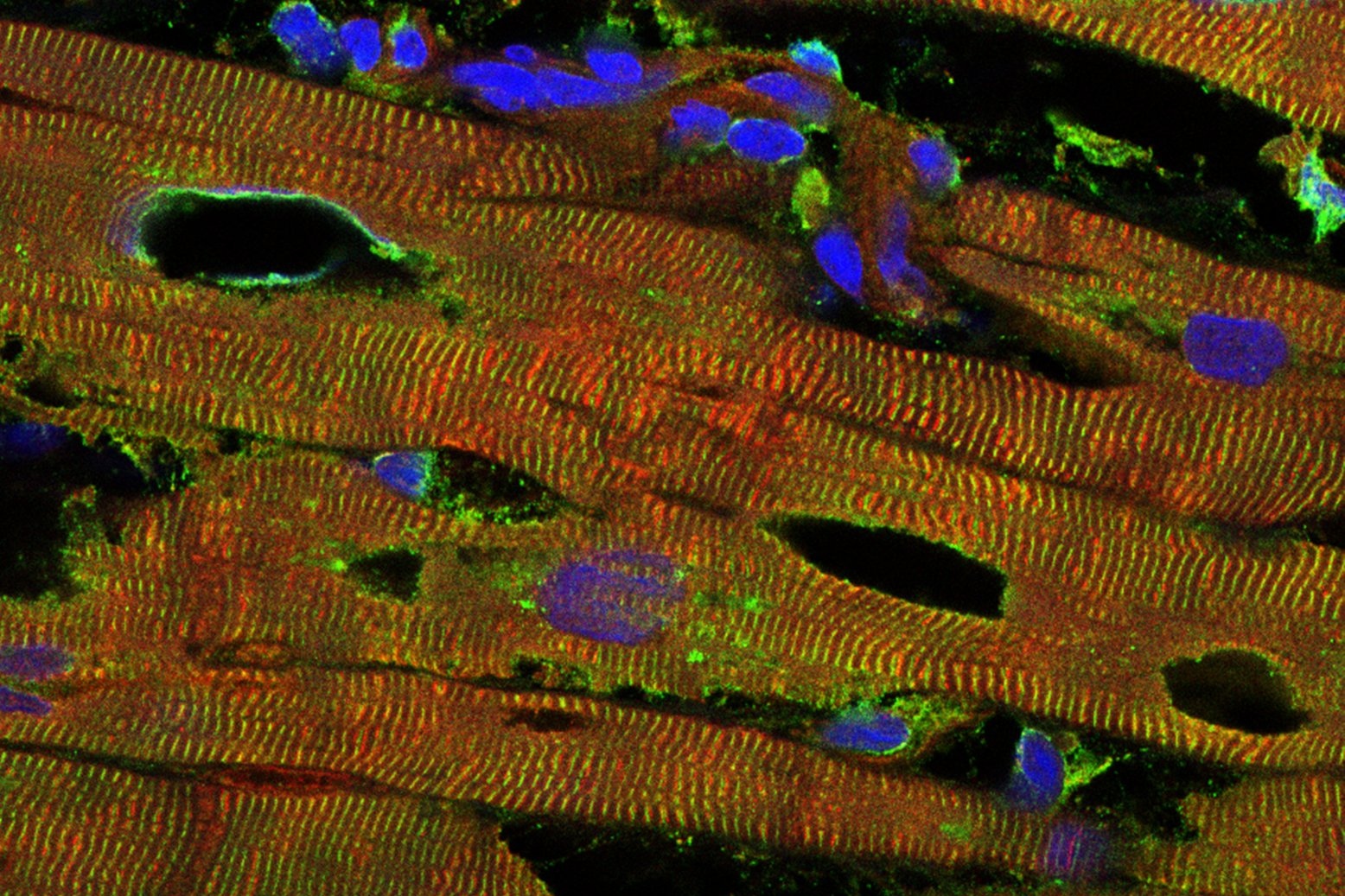
Loescher, C. M.; Freundt, J. K.; (…); Linke, W. A. NOV 2023 | Nature Cardiovascular Research 2: 991-1002. Titin governs myocardial passive stiffness with major support from microtubules and actin and the extracellular matrix.
Begründung der Auswahl:
Inhaltlich beschäftigt sich das Paper mit den passiven mechanischen Eigenschaften des Myokards – diese sind sowohl ein wichtiger Regulator der normalen Herzfunktion als auch eine häufige Ursache für diastolische Dysfunktion bei Herzerkrankungen. Unter Zuhilfenahme eines neuartigen Mausmodells können die Autoren die elastischen und viskösen Kraftbeiträge einzelner Myokardkomponenten entziffern. Titin trägt dabei hauptsächlich zu den elastischen Kräften bei, während die Mikrotubuli und Titin, gefolgt von Aktin, die viskösen Kraftbeiträge dominieren, wobei die extrazelluläre Matrix ebenfalls substantiell beiträgt. Die Ergebnisse ermöglichen nicht nur ein verbessertes Verständnis der mechanischen Architektur des Herzens, sondern bieten möglicherweise Ansatzpunkte zur Bekämpfung der passiven Myokardsteifheit bei Herzinsuffizienz.
Zu Hintergrund, Fragestellung und Bedeutung der Publikation:
Die myokardiale passive Steifigkeit ist entscheidend für die diastolische und die systolische Herzfunktion. Herzversagen beeinflusst diese Steifigkeit durch Veränderungen in der extrazellulären Matrix und den Kardiomyozyten. Mechanisch relevante Kardiomyozyten-Elemente sind vor allem die Mikrotubuli, Aktinfilamente und sarkomerischen Titinfedern. Eine präzise Quantifizierung jeder Komponente ist Voraussetzung für die Therapie von versteiften Herzen.
Die kardiale Titinsteifigkeit wurde erstmals in einem Mausmodell quantifiziert, bei dem eine in die Titinfedern eingefügte genetische Kassette spezifisch durch Tabakätzvirus-Protease geschnitten werden kann. In isolierten Herzmuskelfasern wurden die passiven Dehnungskräfte registriert, während Kardiomyozyten-Elemente (Mikrotubuli, Sarkolemm, Aktin, Titin) extrahiert bzw. geschnitten wurden. Die Messungen zeigten Titin als den dominanten elastischen Kraftbeitragsgeber im Mausherzmuskel, während die Mikrotubuli den größten Beitrag zur viskösen Kraft leisteten, unterstützt von Titin und Aktin. Der Beitrag der extrazellulären Matrix war bei starker Dehnung erheblich, während die Desmin-Intermediärfilamente kaum beitrugen. Die Elemente agierten nicht isoliert, sondern als „Tensegrity“-Struktur.
Diese Ergebnisse beantworten grundlegende Fragen zur Entstehung der passiven Steifigkeit im Myokard und betonen die entscheidende Rolle von Titin zusammen mit den Mikrotubuli, Aktinfilamenten und der Kollagenmatrix. Obwohl sich Maus- und Menschenherzen unterscheiden, deuten die Daten auf potenzielle therapeutische Ansätze für versteifte Herzen hin.
Background and fundamental question of the publication:
Myocardial passive stiffness is vital for heart function, influencing diastolic properties and systolic output. Heart failure can alter this stiffness, caused by changes to both the extracellular matrix and the cardiomyocytes. Components impacting stiffness in cardiomyocytes include the microtubules, actin filaments and sarcomeric titin springs. Quantifying each component's mechanical role is crucial to therapeutic targeting of stiffened hearts.
Titin stiffness was determined by using a mouse model with a genetic cassette inserted into elastic titin, which can be cleaved specifically and acutely by tobacco etch virus protease. In isolated cardiac fibers, mechanically relevant cardiomyocyte elements (microtubules, sarcolemma, actin filaments) were disrupted one by one and their respective stiffness contributions compared, before titin was cleaved as well. This approach revealed titin as the dominant elastic force contributor in mouse myocardium, while microtubules led viscous forces, supported by titin and actin. Stiffness contributions from the extracellular matrix were substantial at high strain, whereas the desmin intermediate filaments barely contributed. Elements did not act in isolation, indicating a tensegrity relationship.
These findings answer fundamental questions about the origin of passive stiffness in myocardium, emphasizing the critical role of titin in concert with the microtubules, actin filaments, and the collagen matrix. Although mouse hearts cannot be directly compared to human hearts, the results suggest potential therapeutic targets for stiffened hearts.
Die bisherigen ausgezeichneten „Papers of the Month“ finden Sie HIER.