News
Zellen neu beleuchtet: Zweistrahl-Laser-Massenspektrometrie-Verfahren liefert neuartige Einblicke in den Aufbau von Zellen und Geweben
Prof. Klaus Dreisewerd (l.) und Dr. Jens Soltwisch 2017 bei der Installation des von der DFG geförderten Massenspektrometers im Institut für Hygiene (Foto: Ivan Kouzel)
Münster (mfm/sw) - Zellen: die Grundbausteine des Lebens – als solche werden sie bereits seit der Erfindung des Lichtmikroskops im 17. Jahrhundert intensiv untersucht. Die Entwicklung von massenspektrometrischen (MS) Verfahren – solchen, die die chemische Zusammensetzung von Zellen bestimmen – war ein weiterer Meilenstein für die zellbiologische Forschung. In der aktuellen Ausgabe der Fachzeitschrift Nature Methods stellt die Arbeitsgruppe von Prof. Klaus Dreisewerd und Dr. Jens Soltwisch vom Institut für Hygiene der Universität Münster (WWU) nun ein Verfahren vor, durch das die räumliche Auflösung der bildgebenden MALDI-Massenspektrometrie auf rund ein tausendstel Millimeter verbessert wurde.
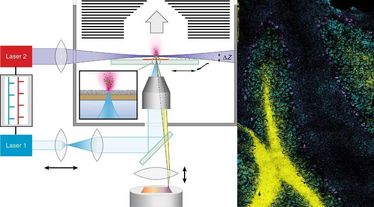
MALDI steht für Matrix-unterstütze Laserdesorption/Ionisation. Das Besondere an der von den Forschern t-MALDI-2 genannten Technik („t“ für Transmissionsmodus) ist der Einsatz zweier speziell adaptierter Laser, von denen der erste einen besonders kleinen Fokus zum Materialabtrag erzeugt, während der zweite die notwendige Signalsteigerung für viele Biomoleküle um bis zu mehreren Größenordnungen bringt – also zum Beispiel für fettlösliche Vitamine wie Vitamin D, Cholesterin oder auch verabreichten Medikamente. Die Information über deren präzise räumliche Verteilung in Zellen und Geweben kann unter anderem zu einem verbesserten Verständnis von Krankheits- und Infektionsprozessen beitragen und neue Behandlungsstrategien aufzeigen.
MALDI-MS-Verfahren bestimmen die Natur und Zusammensetzung von Molekülen anhand ihrer charakteristischen Masse, das heißt, ihrem „molekularen Gewicht“. So lassen sich aus einer mit dem Laser bestrahlten Probe - wie einem dünnen Gewebeschnitt, der aus einer Biopsie gewonnen wurde - oft Dutzende bis Hunderte verschiedener Biomoleküle in einer einzigen Messung gleichzeitig bestimmen. Allerdings lag die Auflösung der bildgebenden Massenspektrometrie bislang deutlich unter der der klassischen Lichtmikroskopie - durch die Einführung der neuen t-MALDI-2-Technik konnte diese Lücke deutlich verkleinert werden.
„Die entscheidende Verbesserung unserer Methodik gegenüber etablierten bildgebenden MALDI-Verfahren basiert auf der Kombination und der Erweiterung zweier zuvor eingeführter technischer Ansätze“, erläutert Dr. Marcel Niehaus, einer der beiden Erstautoren der Studie. „Zum einen beschießen wir in der Transmissionsgeometrie unsere Proben rückseitig. Hierdurch wird es möglich, hochwertige Mikroskop-Objektive sehr nah an der Probe zu platzieren und so den Laserpunkt zu verkleinern, anders als dies aus geometrischen Gründen bei Standardverfahren möglich ist, wo die Proben aus der Richtung des Massenanalysators bestrahlt werden.“ Allerdings steht in den winzigen Probenbereichen, die so vom Laser abgetragen werden, nur noch extrem wenig Material für die anschließende MS-Messung zur Verfügung. Der zweite entscheidende Schritt war daher die Nutzung einer Methode (MALDI-2 genannt), welche die Forscher 2015 bereits mit einer Publikation in der „Science“ in die Fachwelt eingeführt hatten. Im Effekt sorgt der sogenannte Nachionisationslaser für eine verstärkte Überführung der zunächst ungeladenen Moleküle in eine ionische Form – nur, wenn die Moleküle mit einer positiven oder negativen Ladung versehen sind, sind sie für den Massenanalysator auch sichtbar.
In ihrer Studie demonstrieren die Wissenschaftler die Möglichkeiten ihrer Technik anhand der Feinstrukturen im Aufbau des Kleinhirns der Maus und mittels gezüchteter Kulturen von Nierenzellen. „Mit unserem Verfahren könnten künftig die Abläufe vieler Prozesse im Körper auf molekularer Ebene deutlich besser verstanden werden“, freut sich Prof. Dreisewerd. „Zudem könnten etablierte Verfahren aus der Lichtmikroskopie, zum Beispiel zur Fluoreszenzmikroskopie, mit der bildgebenden Massenspektrometrie an einem ‚multimodalen‘ Instrument fusioniert werden“, blickt der Projektleiter nach vorn.