News
Neue Erkenntnisse zum schweren Entzündungssyndrom bei Kindern nach SARS-CoV-2-Infektion
Münster (uks/mfm) - Einem multidisziplinären Team ist es in einer multizentrischen Studie gelungen, einen neuen Mechanismus bei der Entstehung schwerer Entzündungszustände bei Kindern nach SARS-CoV-2-Infektion aufzudecken. Nach den jetzt im Fachjournal „The Lancet Rheumatology“ publizierten Erkenntnissen behindern neu entdeckte Antikörper die Funktion körpereigener Entzündungshemmer. Beteiligt an der interdisziplinären Arbeitsgruppe waren auch Wissenschaftler der Westfälischen Wilhlms-Universität (WWU) Münster.
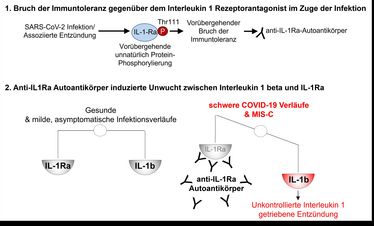
Für das Projekt wurden Blutplasma-Proben von Patientinnen und Patienten im Alter bis 18 Jahren aus fünf großen deutschen und einer spanischen Klinik analysiert. In über 60 Prozent der untersuchten Fälle konnten bei dem so genannten Multisystemischen Entzündungssyndrom bei Kindern („Multisystem Inflammatory Syndrome in Children“, kurz: MIS-C; auch als „Pediatric Inflammatory Multisystem Syndrome“ – PIMS bezeichnet) spezielle Autoantikörper gegen einen zentralen körpereigenen Entzündungshemmer namens Interleukin-1-Rezepetor-Antagonist nachgewiesen werden.
Bei Kindern mit asymptomatischen oder milden COVID-19-Verläufen oder bei jenen mit anderen systemischen Erkrankungen (Kawasaki-Syndrom, Arthritis im Kindesalter, bestimmte Wachstumsstörungen) konnten diese speziellen Autoantikörper hingegen nicht nachgewiesen werden – ebenso wenig wie in der Kontrollgruppe mit gesunden Kindern und Jugendlichen. Insbesondere im Vergleich zum Kawasaki-Syndrom ist dies bemerkenswert, betonen die Forscher, da dieses Syndrom dem MIS-C in klinischer Präsentation, Laborwerten und Behandlungsansätzen stark ähnelt.
Interleukin-1 ist ein wichtiger Botenstoff, der bei Infekten an der Alarmierung und Mobilisierung des Immunsystems beteiligt ist – er bewirkt beispielsweise Fieber. Ist die Interleukin-Ausschüttung allerdings zu hoch, können viele entzündliche Krankheiten, etwa Rheuma oder Arthritis, entstehen. Unser Immunsystem reguliert sich normalerweise selbst: Interleukine haben natürliche Gegenspieler, die gegebenenfalls überschießende Entzündungsreaktionen bremsen. Bei dem Interleukin-1-Rezeptor-Antagonisten handelt es sich um einen solchen natürlichen Gegenspieler des Interleukin-1-Signalweges, eines wichtigen Entzündungssignalweges.
„Die in unserer Studie neu entdeckten Autoantikörper binden freie Interleukin-1-Rezeptor-Antagonisten, so dass diese gehindert werden, ihre natürliche Aufgabe der Entzündungshemmung wahrzunehmen. Infolgedessen kommt es zu einem gefährlichen Ungleichgewicht und somit zu überschießenden Entzündungsreaktionen“, beschreibt Privatdozent Dr. Lorenz Thurner den zugrundeliegenden Mechanismus. Thurner leitet eine Arbeitsgruppe am José-Carreras-Center des Universitätsklinikums des Saarlandes (UKS) in Homburg, die sich mit fehlgeleiteten Autoimmunreaktionen unter anderem bei Krebserkrankungen oder Infektionen beschäftigt. „Überraschenderweise zeigten diese Autoantikörper keine Kreuzreaktivität gegen Strukturbestandteile des SARS-CoV-2-Virus selbst. Vielmehr konnte als Ursache eine zeitlich begrenzt auftretende, sehr ungewöhnliche Sonderform dieses Eiweißes mit einer zusätzlichen Phosphorylierung nachgewiesen werden. Diese wird von Teilen des erworbenen Immunsystems als körperfremd bewertet. Es kommt zu einem Bruch der Immuntoleranz und damit zur Bildung von Autoantikörpern einer speziellen Klasse - IgG1 genannt - gegen diese körpereigenen Entzündungshemmer.“
Dieses Forschungsergebnis konnte nur durch eine enge und multidisziplinäre Kooperation sehr verschiedener Fachrichtungen erzielt werden. Beteiligt waren neben der Arbeitsgruppe um Lorenz Thurner das Team von Privatdozent Dr. Christoph Kessel (Kinderrheumatologie der WWU Münster) sowie Dr. Jochen Pfeifer (UKS) und Dr. Bernhard Thurner (Klinikum Kempten). Die Unterstützung durch Prof. Michael Kabesch (KUNO Regensburg) war ebenfalls wichtig; seine Proben dienten als wichtige Kontrollen. Daneben konnten die Forscher Kawasaki-Proben von der LMU München erhalten. Zahlreiche weitere Kliniken, Institute und Zusammenschlüsse von Forschenden aus Deutschland, Europa und Israel trugen zu der Arbeit bei.
Die Forschungen stießen bereits auf großes Interesse in der Fachwelt. Nach der Veröffentlichung in der Fachpresse wurden die Autoren eingeladen, ihre Erkenntnisse in einem Vortrag auf dem Europäischen Kongress für Klinische Mikrobiologie und Infektionskrankheiten (ECCMID) zu präsentieren.
Der Studie kommt eine besondere Bedeutung zu, da sie zum besseren Verständnis der zugrundeliegenden Mechanismen bei der Entstehung des schweren Entzündungssyndroms bei Kindern nach SARS-CoV2 beiträgt und möglicherweise einen Ansatzpunkt für Immunsystem-regulierende, anti-entzündliche Therapien bietet. Das Team arbeitet weiter an verwandten Projekten. Unterstützt wurde die Studie unter anderem vom Interdisziplinären Zentrum für Klinische Forschung der Medizinischen Fakultät Münster.