News
Münstersche Forscher entschlüsseln mittels iPS-Technologie Ursachen des Plötzlichen Herztods
Münster (mpi) - Seltene Erkrankungen sind ein Sammelbegriff für erblich bedingte Leiden, die durch Defekte in einzelnen Genen hervorgerufen werden. Das Erkennen der zugrundeliegenden Mechanismen und die Entwicklung personalisierter Therapie-Möglichkeiten stellt Forscher oft vor große Herausforderungen. Mittels patientenspezifischen, reprogrammierten Stammzellen ist es münsterschen Forschern um Dr. Boris Greber vom Max-Planck-Institut für molekulare Biomedizin nun gelungen, wichtige Einblicke in die Ursachen und die mögliche Bekämpfung einer seltenen Herzkrankheit zu erlangen, die den sogenannten plötzlichen Herztod verursacht.
Herzleiden sind die Todesursache Nummer Eins in Industrieländern. Zum Teil sind diese erblich bedingt und zurückzuführen auf Defekte in einzelnen Genen, die für die Herzzellfunktion und die Erregbarkeit der Zellen essentiell sind. Da diese Krankheiten jedoch selten auftreten – laut Definition in weniger als einem von 2.000 Menschen - ist es für die pharmazeutische Industrie wenig attraktiv, spezifische Therapien dafür zu entwickeln. Eine weitere Hürde stellt im Falle genetischer Herzkrankheiten die Tatsache dar, dass das entsprechende Patientengewebe (Herzmuskelzellen) praktisch nicht zugänglich ist, um daran detailliert zu forschen.
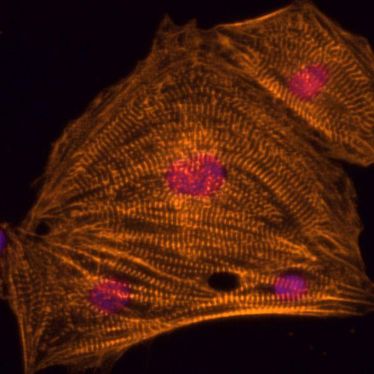
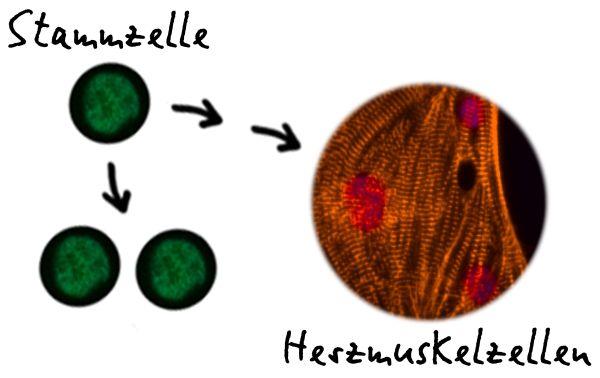
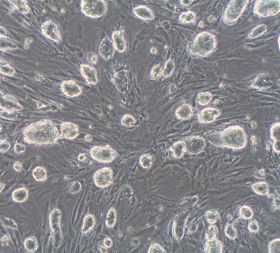
Eine besonders schwere Erkrankung ist das Jervell- und Lange-Nielsen-Syndrom (JLNS): Die Patienten sind sehr anfällig für lebensbedrohliche, stressabhängige Herzrhythmusstörungen, besonders bei körperlicher Anstrengung. Sie sterben meist schon im Kindes- oder Jugendalter. Forscher vom Max-Planck-Institut für molekulare Biomedizin (MPI Münster) und von der Universität Münster haben nun einen anderen Weg eingeschlagen, um das Krankheitsverständnis zu beleuchten: Sie entnahmen Hautzellen eines JLNS-Patienten und programmierten diese zunächst in pluripotente Stammzellen um. Die Stammzellen konnten dann vermehrt und wiederum in spontan schlagende Herzmuskelzellen umgewandelt werden.
"Damit hatten wir erstmals die Gelegenheit, die patientenspezifischen Defekte in den Herzmuskelzellen eingehend im Labor zu untersuchen.", so Dr. Boris Greber, Forschungsgruppenleiter am MPI Münster. "Zwar sind die Herzmuskelzellen, die wir aus den Stammzellen ableiten konnten, nicht identisch mit Herzzellen des Patienten, aber sie teilen wichtige Grundeigenschaften – vor allem tragen sie den genetischen Defekt des Patienten in sich", sagt Dr. Miao Zhang, Erstautorin der Studie.
Tatsächlich verhielten sich die "kranken" Herzmuskelzellen in vielerlei Hinsicht so, wie man es von JLNS- Patienten her kennt: Sie entwickelten Rhythmusstörungen, wenn sie bestimmten Stressbedingungen ausgesetzt wurden. "Das ist bemerkenswert und zeigt, welches Potenzial patientenabgeleitete Stammzellen für die medizinische Forschung haben - sowohl für das im Krankheitsverständnis, als auch zur Prüfung von Therapiemöglichkeiten", sagt Prof. Eric Schulze-Bahr vom Institut für Genetik von Herzerkrankungen der Uniklinik Münster, der die Patienten betreut und genetisch untersucht. Prinzipiell denkbar wäre es, den Gendefekt in den Zellen zu korrigieren und diese dem Patienten zurück zu transplantieren. Dies erscheint jedoch bei genetischen Herzerkrankungen sehr schwierig, weil mitunter sämtliche Zellen des Herzens funktionell gestört sind.
Stattdessen nutzten die Forscher die stammzellabgeleiteten Herzmuskelzellen, um mögliche Wirkstoffe zu testen, welche die überempfindliche Antwort und Störung der Zellen ausgleichen könnten. So konnten mit Hilfe eines Ionenkanalaktivators die stressinduzierten Rhythmusstörungen in den patientenspezifischen Zellen vollständig unterdrückt werden. Ionenkanäle sind porenbildende Proteine in den Zellmembranen, die elektrisch geladenen Teilchen, Ionen, das Durchqueren ermöglichen. Das im Verbund synchrone Kontrahieren von Herzmuskelzellen beruht auf diesen Ionenkanälen. "Dies sind sehr vielversprechende Ergebnisse, die möglicherweise therapeutisches Potenzial für diese Erkrankung haben. Es wird aber nötig sein, die Effektivität der Substanz weiter zu steigern, bevor man an Tests mit Patienten denkt“, sagt Greber.
Neben den münsterschen Forschern waren niederländische Kooperationspartner an dem Projekt beteiligt. Gefördert wurde die Arbeit unter anderem von der Eva-Luise- und Horst-Köhler-Stiftung sowie vom Bundesinstitut für Risikobewertung.
Originalveröffentlichung:
Miao Zhang, Cristina D’Aniello, Arie O. Verkerk, Eva Wrobel, Stefan Frank, Dorien Ward-van Oostwaard, Ilaria Piccini, Christian Freund, Jyoti Rao, Guiscard Seebohm, Douwe E. Atsma, Eric Schulze-Bahr, Christine L. Mummery, Boris Greber, Milena Bellin
Recessive cardiac phenotypes in induced pluripotent stem cell models of Jervell and Lange-Nielsen syndrome: Disease mechanisms and pharmacological rescue
Proceedings of the National Academy of Sciences, 2014, Epub ahead of print, doi:10.1073/pnas.1419553111
Herzleiden sind die Todesursache Nummer Eins in Industrieländern. Zum Teil sind diese erblich bedingt und zurückzuführen auf Defekte in einzelnen Genen, die für die Herzzellfunktion und die Erregbarkeit der Zellen essentiell sind. Da diese Krankheiten jedoch selten auftreten – laut Definition in weniger als einem von 2.000 Menschen - ist es für die pharmazeutische Industrie wenig attraktiv, spezifische Therapien dafür zu entwickeln. Eine weitere Hürde stellt im Falle genetischer Herzkrankheiten die Tatsache dar, dass das entsprechende Patientengewebe (Herzmuskelzellen) praktisch nicht zugänglich ist, um daran detailliert zu forschen.
Eine besonders schwere Erkrankung ist das Jervell- und Lange-Nielsen-Syndrom (JLNS): Die Patienten sind sehr anfällig für lebensbedrohliche, stressabhängige Herzrhythmusstörungen, besonders bei körperlicher Anstrengung. Sie sterben meist schon im Kindes- oder Jugendalter. Forscher vom Max-Planck-Institut für molekulare Biomedizin (MPI Münster) und von der Universität Münster haben nun einen anderen Weg eingeschlagen, um das Krankheitsverständnis zu beleuchten: Sie entnahmen Hautzellen eines JLNS-Patienten und programmierten diese zunächst in pluripotente Stammzellen um. Die Stammzellen konnten dann vermehrt und wiederum in spontan schlagende Herzmuskelzellen umgewandelt werden.
"Damit hatten wir erstmals die Gelegenheit, die patientenspezifischen Defekte in den Herzmuskelzellen eingehend im Labor zu untersuchen.", so Dr. Boris Greber, Forschungsgruppenleiter am MPI Münster. "Zwar sind die Herzmuskelzellen, die wir aus den Stammzellen ableiten konnten, nicht identisch mit Herzzellen des Patienten, aber sie teilen wichtige Grundeigenschaften – vor allem tragen sie den genetischen Defekt des Patienten in sich", sagt Dr. Miao Zhang, Erstautorin der Studie.
Tatsächlich verhielten sich die "kranken" Herzmuskelzellen in vielerlei Hinsicht so, wie man es von JLNS- Patienten her kennt: Sie entwickelten Rhythmusstörungen, wenn sie bestimmten Stressbedingungen ausgesetzt wurden. "Das ist bemerkenswert und zeigt, welches Potenzial patientenabgeleitete Stammzellen für die medizinische Forschung haben - sowohl für das im Krankheitsverständnis, als auch zur Prüfung von Therapiemöglichkeiten", sagt Prof. Eric Schulze-Bahr vom Institut für Genetik von Herzerkrankungen der Uniklinik Münster, der die Patienten betreut und genetisch untersucht. Prinzipiell denkbar wäre es, den Gendefekt in den Zellen zu korrigieren und diese dem Patienten zurück zu transplantieren. Dies erscheint jedoch bei genetischen Herzerkrankungen sehr schwierig, weil mitunter sämtliche Zellen des Herzens funktionell gestört sind.
Stattdessen nutzten die Forscher die stammzellabgeleiteten Herzmuskelzellen, um mögliche Wirkstoffe zu testen, welche die überempfindliche Antwort und Störung der Zellen ausgleichen könnten. So konnten mit Hilfe eines Ionenkanalaktivators die stressinduzierten Rhythmusstörungen in den patientenspezifischen Zellen vollständig unterdrückt werden. Ionenkanäle sind porenbildende Proteine in den Zellmembranen, die elektrisch geladenen Teilchen, Ionen, das Durchqueren ermöglichen. Das im Verbund synchrone Kontrahieren von Herzmuskelzellen beruht auf diesen Ionenkanälen. "Dies sind sehr vielversprechende Ergebnisse, die möglicherweise therapeutisches Potenzial für diese Erkrankung haben. Es wird aber nötig sein, die Effektivität der Substanz weiter zu steigern, bevor man an Tests mit Patienten denkt“, sagt Greber.
Neben den münsterschen Forschern waren niederländische Kooperationspartner an dem Projekt beteiligt. Gefördert wurde die Arbeit unter anderem von der Eva-Luise- und Horst-Köhler-Stiftung sowie vom Bundesinstitut für Risikobewertung.
Originalveröffentlichung:
Miao Zhang, Cristina D’Aniello, Arie O. Verkerk, Eva Wrobel, Stefan Frank, Dorien Ward-van Oostwaard, Ilaria Piccini, Christian Freund, Jyoti Rao, Guiscard Seebohm, Douwe E. Atsma, Eric Schulze-Bahr, Christine L. Mummery, Boris Greber, Milena Bellin
Recessive cardiac phenotypes in induced pluripotent stem cell models of Jervell and Lange-Nielsen syndrome: Disease mechanisms and pharmacological rescue
Proceedings of the National Academy of Sciences, 2014, Epub ahead of print, doi:10.1073/pnas.1419553111