News
In zwei Schritten zu Herzmuskelgewebe: Münstersche Forscher entschlüsseln Mechanismus zur Erzeugung menschlicher Herzmuskelzellen
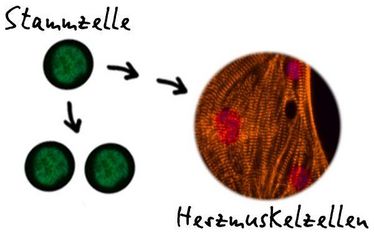
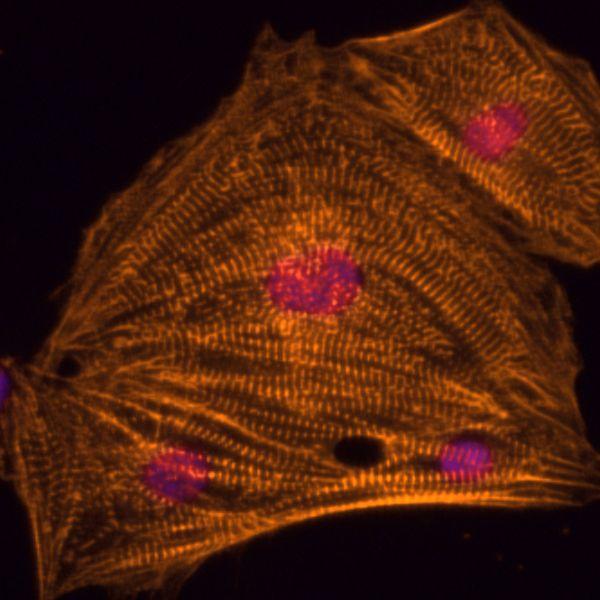
Münster - Aus pluripotenten Stammzellen erzeugtes Herzmuskelgewebe gewinnt für die Biomedizin zunehmend an Bedeutung. Dabei versuchen Forscher, die natürlichen Prozesse im frühen Embryo nachzuahmen. Durch Erkenntnisse der Entwicklungsbiologie haben sie zwar Hinweise, welche Gene bei diesen Prozessen eine Rolle spielen. Doch wie die Differenzierung in Herzmuskelgewebe gesteuert wird, war bislang weitgehend unbekannt. Die Max-Planck-Forschungsgruppe um Dr. Boris Greber und Kollegen von der Universität Münster haben nun diesen Mechanismus in menschlichen Zellen entschlüsselt und ihn in der „Cell Stem Cell“ beschrieben. Vor allem bei der Anwendung von aus Patientenzellen abgeleiteten Herzmuskelzellen für die Krankheits- und Medikamentenforschung sind diese Ergebnisse von hoher Relevanz.
Das Herz ist das erste Organ, das im Zuge der Embryonalentwicklung entsteht. Die molekularen Abläufe der Herzentwicklung sind jedoch schwierig zu untersuchen und im menschlichen Embryo unzugänglich. Untersuchungen an Mausembryonen liefern zwar wichtige Erkenntnisse. Um aber menschliche Herzmuskelzellen für die Erforschung von Krankheitsaspekten oder für die Medikamentenentwicklung zu erzeugen, ist es notwendig zu verstehen, welche Prozesse gerade die Herzmuskelentwicklung menschlicher Zellen steuern.
In zwei Schritten zu Herzmuskelzellen – so einfach ist wohl der Mechanismus, der humane pluripotente Stammzellen zu Herzmuskelzellen werden lässt. „Wir haben zwei molekulare ‚Hindernisse’ identifiziert, die dazu überwunden werden müssen“, sagt Boris Greber, Forschungsgruppenleiter des Human Stem Cell Pluripotency Laboratory am Max-Planck-Institut (MPI) für molekulare Biomedizin. „Man kann sich das auch vorstellen wie zwei aufeinander folgende Schalter: Nur wenn beide in der richtigen Position sind, ist der Weg für die Stammzellen frei“, fügt Prof. Dr. Guiscard Seebohm, Abteilungsleiter am Institut für Genetik von Herzerkrankungen der Medizinischen Fakultät der Universität Münster, hinzu.
Das erste Hindernis stellt das Gen SOX2 dar und kann von den Signalstoffen BMP und WNT unterdrückt werden. SOX2 hemmt die Differenzierung in Mesodermzellen, aus denen sich später Herzmuskelzellen bilden können. „Zwar war schon bekannt, dass BMP und WNT für die Differenzierung von pluripotenten Zellen in Mesodermzellen wichtig sind“, erklärt Jyoti Rao, Doktorandin in Grebers Arbeitsgruppe und Erstautorin der Studie. „Wir konnten aber nun zeigen, dass diese Faktoren spezifisch auf SOX2 wirken. Durch Aktivierung dieser Signalwege konnten wir die SOX2-Blockade aufheben und so Mesodermzellen entstehen lassen. Und das funktioniert fantastisch gut und schnell.“
Im zweiten Schritt muss hingegen der WNT-Signalweg wieder inaktiviert werden. Erst dann können die Mesodermzellen weiter zu Herzmuskelzellen differenzieren. „Ein zweischneidiges Schwert sozusagen, denn wir haben herausgefunden, dass dieser Signalweg auch die Gene MSX und CDX aktiviert, welche die weitere Differenzierung in Herzmuskelgewebe hemmen“, sagt Greber. MSX und CDX stellen zusammen also das zweite Hindernis dar, das aus dem Weg geräumt werden muss. „Unsere Ergebnisse zeigen zum ersten Mal ziemlich genau, wie sich menschliche pluripotente Stammzellen zu Herzmuskelzellen entwickeln. Mit diesen Zellen kann man also quasi einzelne Aspekte der menschlichen Frühentwicklung nachvollziehen. Das ist wirklich erstaunlich.“
„Mit unserem nun herausgearbeiteten Protokoll können wir innerhalb einer Woche schlagende Herzmuskelzellen in hoher Reinheit erzeugen“, sagt Rao. „Im Vergleich zur Differenzierung von anderen Körperzellen ist das bemerkenswert schnell“, sagt sie. Im nächsten Schritt möchten die Forscher die molekularen Abläufe noch detaillierter untersuchen. „Letztendlich möchten wir wissen, wie wir direkte Vorläuferzellen des Herzens isolieren und vermehren können“, sagt Greber. „Das würde den Prozess weiter vereinfachen und wir könnten damit ausreichende Mengen an Herzmuskelzellen für die Krankheits- und Medikamentenforschung produzieren.“
Link zur Publikation (folgt)
Das Herz ist das erste Organ, das im Zuge der Embryonalentwicklung entsteht. Die molekularen Abläufe der Herzentwicklung sind jedoch schwierig zu untersuchen und im menschlichen Embryo unzugänglich. Untersuchungen an Mausembryonen liefern zwar wichtige Erkenntnisse. Um aber menschliche Herzmuskelzellen für die Erforschung von Krankheitsaspekten oder für die Medikamentenentwicklung zu erzeugen, ist es notwendig zu verstehen, welche Prozesse gerade die Herzmuskelentwicklung menschlicher Zellen steuern.
In zwei Schritten zu Herzmuskelzellen – so einfach ist wohl der Mechanismus, der humane pluripotente Stammzellen zu Herzmuskelzellen werden lässt. „Wir haben zwei molekulare ‚Hindernisse’ identifiziert, die dazu überwunden werden müssen“, sagt Boris Greber, Forschungsgruppenleiter des Human Stem Cell Pluripotency Laboratory am Max-Planck-Institut (MPI) für molekulare Biomedizin. „Man kann sich das auch vorstellen wie zwei aufeinander folgende Schalter: Nur wenn beide in der richtigen Position sind, ist der Weg für die Stammzellen frei“, fügt Prof. Dr. Guiscard Seebohm, Abteilungsleiter am Institut für Genetik von Herzerkrankungen der Medizinischen Fakultät der Universität Münster, hinzu.
Das erste Hindernis stellt das Gen SOX2 dar und kann von den Signalstoffen BMP und WNT unterdrückt werden. SOX2 hemmt die Differenzierung in Mesodermzellen, aus denen sich später Herzmuskelzellen bilden können. „Zwar war schon bekannt, dass BMP und WNT für die Differenzierung von pluripotenten Zellen in Mesodermzellen wichtig sind“, erklärt Jyoti Rao, Doktorandin in Grebers Arbeitsgruppe und Erstautorin der Studie. „Wir konnten aber nun zeigen, dass diese Faktoren spezifisch auf SOX2 wirken. Durch Aktivierung dieser Signalwege konnten wir die SOX2-Blockade aufheben und so Mesodermzellen entstehen lassen. Und das funktioniert fantastisch gut und schnell.“
Im zweiten Schritt muss hingegen der WNT-Signalweg wieder inaktiviert werden. Erst dann können die Mesodermzellen weiter zu Herzmuskelzellen differenzieren. „Ein zweischneidiges Schwert sozusagen, denn wir haben herausgefunden, dass dieser Signalweg auch die Gene MSX und CDX aktiviert, welche die weitere Differenzierung in Herzmuskelgewebe hemmen“, sagt Greber. MSX und CDX stellen zusammen also das zweite Hindernis dar, das aus dem Weg geräumt werden muss. „Unsere Ergebnisse zeigen zum ersten Mal ziemlich genau, wie sich menschliche pluripotente Stammzellen zu Herzmuskelzellen entwickeln. Mit diesen Zellen kann man also quasi einzelne Aspekte der menschlichen Frühentwicklung nachvollziehen. Das ist wirklich erstaunlich.“
„Mit unserem nun herausgearbeiteten Protokoll können wir innerhalb einer Woche schlagende Herzmuskelzellen in hoher Reinheit erzeugen“, sagt Rao. „Im Vergleich zur Differenzierung von anderen Körperzellen ist das bemerkenswert schnell“, sagt sie. Im nächsten Schritt möchten die Forscher die molekularen Abläufe noch detaillierter untersuchen. „Letztendlich möchten wir wissen, wie wir direkte Vorläuferzellen des Herzens isolieren und vermehren können“, sagt Greber. „Das würde den Prozess weiter vereinfachen und wir könnten damit ausreichende Mengen an Herzmuskelzellen für die Krankheits- und Medikamentenforschung produzieren.“
Link zur Publikation (folgt)