APOL1 als Risikofaktor für Nierenerkrankungen
APOL1 als Risikofaktor für Nierenerkrankungen
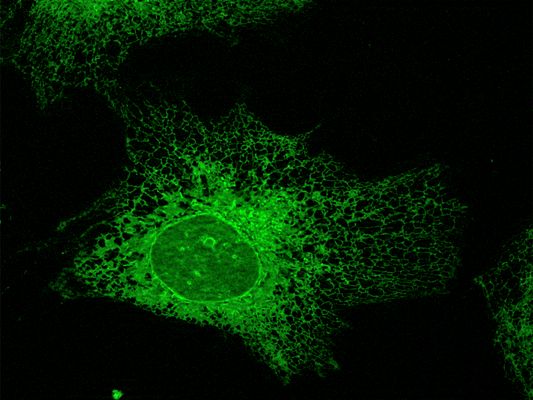
Unterarten des einzelligen Parasiten Trypanosoma brucei verursachen die Afrikanische Schlafkrankheit (auch Afrikanische Trypanosomiasis). Die Tropenerkrankung wird von der Tsetse-Fliege übertragen und kommt vor allem in verschiedenen tropischen Gebieten Afrikas vor. Im Blutserum des Menschen befindet sich ein Faktor der die Menschen normalerweise vor dieser Erkrankung schützt. 2003 wurde dieser Faktor als APOL1 (von: Apolipoprotein L1) identifiziert. Dabei ist APOL1 – das nur im Menschen und wenigen anderen höheren Primaten vorkommt – notwendig und ausreichend um diesen trypanolytischen Effekt hervorzurufen.
Ein ko-evolutiver Prozess zwischen dem SRA-Resistenzgen (von: serum resistance associated protein) der Trypanosomen und dem trypanolytischen Faktor APOL1 hat zu zwei APOL1-Genvarianten geführt (G1 und G2), die insbesondere bei Afroamerikaner*innen und in der westafrikanischen Bevölkerung recht häufig vorkommen.
Im Jahr 2010 konnten zwei Forschergruppen unabhängig voneinander zeigen, dass genau diese APOL1-Varianten mit einem höheren Risiko für HIV-assoziierte Nephropathie (HIVAN) verbunden sind. In späteren Studien wurde dieser Zusammenhang mehrfach bestätigt. Gleichzeitig wurde deutlich, dass homozygote Träger dieser APOL1-Varianten auch für andere Nierenerkrankungen ein höheres Risiko in sich tragen.
Allerdings wird nicht jeder Träger von APOL1-Risikovarianten auch krank. Man vermutet daher, dass für den Ausbruch einer Nierenerkrankung neben der genetischen Disposition mindestens ein weiter Faktor (second hit) notwendig ist. Erhöhte Zytokin-Konzentrationen wie beispielsweise von Inteferonen, oder Virusinfektionen (v. a. HIV- oder COVID-Infektionen) könnten hierbei eine besonders wichtige Rolle spielen.
Die APOL1-Forschung befindet sich damit auf der Schnittstelle zwischen Parasitologie, Evolutionsbiologie, Infektiologie und Nephrologie. Auf molekularer Ebene ist aber noch weitgehend unklar, welche Funktion APOL1 normalerweise in der Zelle ausübt und inwieweit sich APOL1 hier von den anderen Mitgliedern der APOL-Genfamilie unterscheidet. In Vorarbeiten konnten wir bereits zeigen, dass APOL1 v. a. am Endoplasmatischen Retikulum (ER) lokalisiert ist und eine erhöhte Expression der APOL1-Risikovarianten zu einer Energie-Depletion der Zellen führt.
In unserem von der DFG geförderten Projekt (WE 2550/3-1 & 3-2; Projektnummer 324783603) versuchen wir nun v. a. mit zellbiologischen Ansätzen den Einfluss von APOL1 auf ER-assoziierte Funktionen (z. B. Biosynthese, Proteinsekretion) genauer zu analysieren.Die Bedeutung des Crumbs 2 Proteins für Podozyten
Die Bedeutung des Crumbs2 Proteins für Podozyten
Unter Zellpolarität versteht man die geordnete, aber asymmetrische Verteilung von Proteinen und Membrankomponenten in einer Zelle. Sie stellt deshalb die Grundlage vieler zellulärer Prozesse dar. Sowohl die Zellpolarisierung als auch die damit einhergehende Ausbildung von Zell-Zell-Kontakten (tight junctions und adherens junctions) wird über in der Evolution stark konservierte Multiproteinkomplexe gesteuert.
Hierzu gehört der Crumbs-Komplex, der die Kernkomponenten Crumbs, Pals1 (siehe Projekt Pals1) und Patj enthält, und vor allem die Etablierung apikaler Membranen in der Plasmamembran reguliert.
Im Menschen gibt es drei verschiedene Crumbs-Gene (CRB1, CRB2 und CRB3). Die Crumbs-Proteine enthalten alle eine N-terminale extrazelluläre Domäne (ECM), eine Transmembrandomäne (TMD) sowie eine C-terminale intrazelluläre Domäne (ICD). Unterschiede gibt es v. a. in der ECD, die bei den CRB1 und CRB2 Proteinen sehr groß ist und verschiedene EGF-like und Laminin G Domänen enthält. Den sehr viel kleineren CRB3-Proteinen hingegen fehlt ein Großteil der ECD.
In der Niere werden CRB2, und die zwei Splice-Varianten von CRB3, CRB3A und CRB3B, exprimiert. Beide CRB3-Isoformen findet man in allen renalen Epithelien, CRB2 hingehen wird v. a. in glomerulären Podozyten exprimiert. Hierbei handelt es sich um hochpolare, postmitotische Zellen der glomerulären Filtrationsbarriere. Zwischen ihren stark verzweigten Zellfortsätzen bilden Podozyten einzigartige, nur in diesem Zelltyp vorkommende Zell-Zellkontakte aus, die auch als Schlitzmembran bezeichnet werden.
Kürzlich wurde gezeigt, dass bestimmte Mutationen im humanen CRB2-Gen mit schweren Schäden der renalen Filtrationsbarriere verbunden sind. Dies deutet darauf hin, dass es CRB2-spezifische primär für Podozyten wichtige Funktionen gibt.
Ziel unseres DFG geförderten Projektes (DFG WE 2550/2-2; Projektnummer 469263956) ist es, die zellbiologischen Funktionen von CRB2 und ihre Bedeutung für Podozyten genauer zu analysieren. Dazu setzen wir verschiedene Zellsysteme in Kombination mit mikroskopischen Verfahren ein. Das Projekt wird in enger Zusammenarbeit mit Arbeitsgruppe von Prof. Ulrich Kubitscheck (Biophysikalische Chemie, Rheinischen Friedrich-Wilhelms-Universität Bonn) durchgeführt.Die Rolle von Pals1 für Signalübertragungsprozesse in Epithelien
Die Rolle von Pals1 für Signalübertragungsprozesse in Epithelien
Die Niere der Säuger besteht aus etwa 1-2 Millionen physiologischen Untereinheiten, die auch als Nephrone bezeichnet werden und die man grob weiter in einen Glomerulus und einen Tubulus unterteilen kann.
Die Filtration des Blutserums wird über die Glomeruli organisiert. Die Rückgewinnung von wichtigen Biomolekülen (z. B. Wasser, Salze, Zucker, Aminosäuren, etc.) und damit einhergehende Konzentrierung des Primärharns wird dagegen überwiegend durch die einzelnen tubulären Epithelien des Nephrons (auch Segmente genannt) sichergestellt. Obwohl sich die Epithelien der verschiedenen Nephron-Segmente morphologisch und physiologisch stark unterscheiden, zeigen sie alle ausgeprägte apiko-basale Zellpolarisierung.
In Vorarbeiten haben wir deshalb analysiert, welche Rolle Pals1 für die verschiedenen renalen Epithelien spielt, da Pals1 (Gen: MPP5) über seine verschiedenen Domänen mit allen Komponenten des Crumbs-Komplexes interagiert und darüber hinaus auch die Wechselwirkungen des Crumbs-Komplexes mit einem weiteren Polaritätskomplex (aPKC-komplex) vermittelt.
Wir konnten zeigen, dass Mäuse mit einer reduzierten Pals1-Expression im Nephron Zystennieren und eine schwere Proteinurie entwickeln, was auf eine defekte Tubulus-Epithelien und eine gestörte renal Filtrationsbarriere hinweist. Die starken Schädigungen gehen mit einer Veränderung des Hippo- und TGFβ-Signalings einher. Dieses deutet darauf hin, dass Pals1 nicht nur strukturell für die auch eine wichtige Schaltstelle für Signalübertragungen darstellt.
Dieses DFG-Projekt (DFG WE2550/4-1; Projektnummer 414057425) wird in enger Zusammenarbeit mit der Gruppe von Prof. Michael Krahn (Medizinische Zellbiologie, MedD, Münster) durchgeführt und ist darüber hinaus Teil des DFG-Schwerpunkt-programms „Epithelial intercellular junctions as dynamic hubs to integrate forces, signals and cell behaviour (SPP1782)“.

