INF2 und fokal segmentale Glomerulosklerose (FSGS)
INF2 und fokal segmentale Glomerulosklerose (FSGS)
Podozytopathien reichen von seltenen genetischen Erkrankungen, wie dem kongenitalen nephrotischen Syndrom, bis hin zu häufigen erworbenen Erkrankungen, wie der hypertensiven Nephropathie. Die fokale segmentale Glomerulosklerose (FSGS) ist eine histologisch definierte Podozytenerkrankung, die genetische und erworbene Ursachen hat. Bei der FSGS kommt es zu einer Schädigung des Podozyten mit einer Fußfortsatzretraktion, einer Proteinurie und einem Podozytenverlust, der zu einer fortschreitenden Glomerulosklerose führt.
Podozyten bilden den trennschärfsten Teil der glomerulären Filtrationsbarriere. Sie besitzen primäre Fußfortsätze, die sich in zahlreiche sekundäre miteinander interdigitierende Fußfortsätze aufteilen und so ein Netzwerk um die glomerulären Kapillaren bilden. Die sekundären Fußfortsätze der Podozyten sind durch einen Filtrationsschlitz voneinander getrennt, der durch die sog. Schlitzmembran überbrückt wird. Sie ist ein durch ein miteinander interagierendes Proteinnetzwerk aufgebauter Zell-Zell-Kontakt. Zahlreiche Proteine, wie Nephrin, Podocin und die intrazellulären Proteine CD2AP und ZO-1, formen den Schlitzmembrankomplex in den Fußfortsätzen des Podozyten (H. Pavenstädt et al., Physiol Rev, 2003).
Die Dehn- und Spannungskräfte, denen der Podozyt ausgesetzt ist werden durch das Aktinzytoskelett in seinen Fußfortsätzen antagonisiert. Das morphologische Zeichen nahezu aller Podozytenerkrankungen ist eine mit einer Umstrukturierung des Aktinzytoskeletts einhergehende Retraktion der Fußfortsätze. In den letzten Jahren wurden ca. 40 monogenetische Mutationen identifiziert, die zu einer FSGS führen. Ein Teil dieser monogenetischen Podozytenerkrankungen wird durch Mutationen von im Podozyten exprimierter Aktin-assozierter Proteine, wie ACTN4, INF2, MYO1E, MYH9, und ANLN, verursacht. Diese Mutationen gehen mit unterschiedlichen Störungen der Podozytenfunktion einher, die zum Teil noch nicht verstanden sind.
INF2 Mutationen sind die häufigste Ursache für autosomal dominante FSGS-Formen (C. Schell und T.B. Huber, J Am Soc Nephrol, 2017; D. Feng et al., Am J Physiol, 2018). Kürzlich konnte die Gruppe von R. Wedlich-Söldner zeigen, dass INF2 eine entscheidende Rolle bei der durch Calcium-vermittelten Aktin-Reorganisation (CaAR) in Zellen spielt (P. Wales et al., Elife, 2016). Interessanterweise führen krankheitsassoziierte Varianten von INF2 in Podozyten in Kultur, in Nephrozyten von Drosophila melanogaster und in aus dem Urin isolierten Primärzellen von Patient*innen mit einer INF2-Mutation zu einer permanenten Aktin-Reorganisation (S. Bayraktar et al., J Am Soc Nephrol, 2020). Die beobachtete Aktin-Reorganisation kann daher ein Readout für eine systematische Analyse der INF2-assoziierten Mutationen sein.
In den folgenden Jahren wollen wir untersuchen, ob INF2-Reparaturvorgänge in Podozyten stimuliert und welche Rolle INF2 für die Funktion des Podozyten in vivo spielt. Hierzu wurde eine podozytenspezifische INF2-Knockout-Maus generiert.
Das Protein Lasp1: Ein neuer Link zwischen Schlitzmembran und Aktinzytoskelett-Dynamit in Podozyten
Das Protein Lasp1: Ein neuer Link zwischen Schlitzmembran und Aktinzytoskelett- Dynamik in Podozyten
Mitglieder der Nebulinfamilie regulieren die Stabilisierung und die Funktion von Aktinfilamenten im Muskel. Die zwei kleinsten Mitglieder der Familie Lasp1 und Lasp2 werden auch in nichtmuskulärem Gewebe exprimiert. Lasp-1 ist ein Multidomänenprotein mit einer aminoterminalen LIM Domäne, gefolgt von zwei Aktin-bindenden Nebulin Modulen, einer Linker Region und einer Carboxy-terminalen SH3 Domäne. LIM-Domänen sind Protein-Protein-Bindungsmotive mit zwei Zink-koordinierenden Einheiten (E. Butt und D. Raman, Front Oncol, 2018).
Kürzlich konnten wir zeigen, dass Lasp1 in Podozyten an der Schlitzmembran exprimiert wird und mit seinem Aktinzytoskelett verankert ist. Interessanterweise interagiert Lasp1 mit dem Schlitzmembranprotein CD2AP. Ein Knockout von CD2AP führt zu einer Umverteilung der LASP‐1 Expression in Podozyten. In Kooperation mit der Gruppe von Herrn Prof. M. Krahn konnten wir zeigen, dass Lasp1 eine wichtige Rolle für die Schlitzmembranintegrität im Nephrozyten spielt. (C. Lepa, FASEB J, 2020). In den nächsten Jahren werden wir die Rolle des Proteins Lasp1 für die Dynamik des Aktinzytoskeletts des Podoyzten in vitro und in vivo untersuchen.
Die Bedeutung der RabGTPase Rab7 für die Funktion des Podozyten
Die Bedeutung der Rab-GTPase Rab7 für die Funktion des Podozyten
Eine gestörte Balance zwischen Endo- und Autophagozytose spielt eine wichtige Rolle in der Pathogenese renaler Erkrankungen. Unsere Hypothese ist, dass der späte endolysosomale Transport spezifische Funktionen für den Podozyten hat. Um diese Hypothese zu überprüfen haben wir in Mäusen die GTPase Rab7, ein Schlüsselenzym des späten endo- und autolysosomalen Transports, in Podozyten der Maus ausgeschaltet. Mäuse mit einem podozytenspezifischen knockout von Rab7 entwickeln einen schweren Podozytenschaden mit einer Proteinurie.
Mit Hilfe von zellbiologischen Techniken wollen wir den Mechanismus, der zur Entstehung der Podozytopathie, führt verstehen. Das Projekt wird wichtige Erkenntnisse für die Funktion des späten endolysosomalen Transports für die Podozytenfunktion geben.
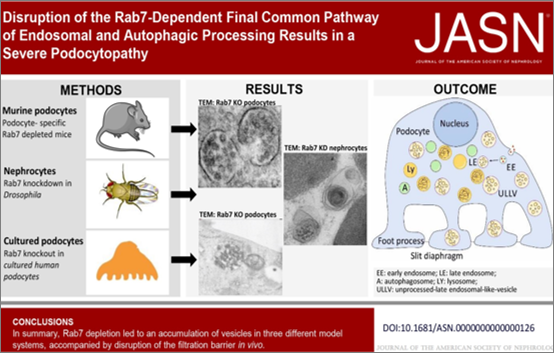
Disruption of the Rab7-Dependent Final Common Pathway of Endosomal and Autophagic Processing Results in a Severe Podocytopathy
Vöing, Kristin et. al., JASN, July 2023
(Journal of the American Society of Nephrology 34Molekulare renale Mechanismen einer ischämischen Präkonditionierung
Molekulare renale Mechanismen einer ischämischen Präkonditionierung
Die akute Nierenschädigung ist eine häufige klinische Komplikation, die mit einer erhöhten Mortalität assoziiert ist. Es gibt keine spezifische Therapie der akuten Niernschädigung (acute kidney injury, AKI). Im Rahmen der Klinischen Forschergruppe KFO 342 "Organdysfunktion im Rahmen systemischer Inflammationssyndrome“ (DFG-Projektnummer 414847370) untersuchen wir in Kooperation mit Frau Prof. Dr. M. Meersch (Klinik für Anästhesiologie, operative Intensivmedizin und Schmerztherapie) in unserem Projekt "Die Wirkung von DAMPs und der entfernten, ischämischen Präkonditionierung auf die Prävention des akuten Nierenversagens (P7)" die renalen Schutzmechanismen nach einer ischämischen Präkonditionierung.
Die ischämische Prädkonditionierung wird durch eine mehrfache Unterbrechung der Armdurchblutung durch Aufpumpen einer Blutdruckmanschette, unterbrochen von zwischenzeitigen Reperfusionsphasen durch Ablassen des Blutdruckmanschettendrucks gewährleistet. Dieses Vorgehen wird auch als ferne (remote) ischämische Präkonditionierung (RIPC) bezeichnet.
Interessante Vorarbeiten aus der Klinik für Anästhesiologie, operative Intensivmedizin und Schmerztherapie haben gezeigt, dass RIPC die Inzidenz eines akuten Nierenversagens in bestimmten Risikogruppen reduziert (A. Zarbock et al., JAMA, 2015). Wir möchten verstehen, über welchen molekularen Mechanismus die vom Muskel freigesetzten Proteine die Niere schützen.
Eine Hypothese ist, dass mittels RIPC aus dem Muskel freigesetztes HMGB1 die Nierentubuli über eine Induktion eines Zellzyklusarrests vor einer Ischämie schützt. Mit Hilfe von zell- und molekularbiologischen Methoden wollen wir unter anderem klären, auf welche Weise RIPC bei einer akuten Nierenschädigung die zellulären Signale von unterschiedlichen mikrodissezierten Tubulusabschnitten der Maus beeinflusst.
source: KFO342

