Meine Gruppe interessiert sich für die molekularen, pathogenetischen Mechanismen seltener genetischer Nierenerkrankungen. Angetrieben von rasanten Fortschritten moderner DNA-Sequenzierungs-verfahren (next-generation sequencing) sind genetische Erkrankungen in den letzten Jahren zunehmend in den Fokus der biomedizinischen Forschung gerückt. Die besondere Stärke dieses Ansatzes besteht darin, dass neue Krankheitsmechanismen direkt an Patientenproben identifiziert werden können, ohne dass vorbekanntes biologisches Wissen zur Hypothesengenerierung genutzt werden muss; es können somit vollkommen neue pathogenetische Mechanismen entschlüsselt werden, die Verständnis von Nierenerkrankungen revolutioniert und zur Entwicklung neuer Therapieverfahren beigetragen haben.
Unsere aktuellen Projekte fokussieren sich auf zwei Gruppen von Genen, die beide eine genetische Podozytenerkrankung auslösen:
1) Der KEOPS Komplex, bestehend aus den Komponenten LAGE3, OSGEP, TP53RK, TPRKB, ist ein evolutionär hochkonservierter, enzymatisch aktiver Multiproteinkomplex mit essentiellen Funktionen in der Proteinbiosynthese. Betroffene Patienten zeigen eine frühkindliche, syndromische Erkrankung, die durch Fehlbildungen des Zentralnervensystems und einen rasch progredienten Verlust der Nierenfunktion gekennzeichnet ist (Galloway-Mowat-Syndrom).
2) Mutationen in verschiedenen Proteinen der Kernpore, einem selektiven Transportkanal zwischen dem Inneren des Zellkerns und dem Zytoplasma, verursachen bei betroffenen Kindern eine angeborene Podozytenerkrankung, die durch das Auftreten eines nephrotischen Syndroms gekennzeichnet ist und bereits im Kindesalter eine chronisch-progrediente Nierenerkrankung auslöst.
Molekulare Pathogenese der Podozytenschädigung durch Mutationen im tRNA-modifizierenden KEOPS Komplex
Molekulare Pathogenese der Podozytenschädigung durch Mutationen im tRNA-modifizierenden KEOPS Komplex
Der KEOPS-Komplex katalysiert eine spezifische, post-transkriptionelle Modifikation von tRNA-Molekülen. Diese Funktion ist evolutionär hochkonserviert, aber bislang noch wenig untersucht. Erst durch unsere genetischen Untersuchungen offenbarte sich ein Bezug zu humanmedizinischen Erkrankungen und es ergab sich die Hypothese einer besonderen Relevanz von tRNA-Modifikationen in Podozyten.
Um aus den genetischen Beobachtungen neue Aufschlüsse über molekulare Pathomechanismen der Podozytenschädigung zu gewinnen, führten wir mit Hilfe etablierter Zellkultursysteme weiterführende Untersuchungen durch. Dabei ergaben sich mehrere interessante Ergebnisse: Zum einen identifizierten wir „endoplasmic reticulum (ER) stress“ als Ursache der Podozytenschädigung und Auslöser der Apoptose in Podozyten. Dieses Ergebnis ist von besonderem Interesse, weil ER Stress und die damit assoziierte Aktivierung der „unfolded protein response“ (UPR) einen vielversprechenden Ansatz für neue, gezielte Therapien der Podozytenschädigung darstellen. Zum anderen detektieren wir, als Folge des Funktionsverlusts von KEOPS, eine verminderte Proteinbiosynthese-Rate. Da Podozyten keine sekretorischen Zellen sind, eröffnet die Frage, warum gerade dieser Zelltyp besonders anfällig für Störungen der Proteinbiosynthese sein könnte, interessante Ansätze für weiterführende Untersuchungen.
Darüber hinaus identifizierten wir eine Reihe von Sekundärphänomenen, die die zentrale Funktion des KEOPS-Komplexes in Podozyten unterstreichen (z.B. genomischen Stress mit Aktivierung der „DNA damage response“-Kaskade und Störungen von Aktin-Homöostase). Zusammenfassend entdeckten wir also einen neuen, bislang unbekannten pathogenetischen Mechanismus der Podozytenschädigung, beschrieben daraus resultierende zelluläre Defekte und identifizierten damit einen vielversprechenden Ansatz für eine zukünftige, gezielte Therapie dieser Erkrankung.
Unsere aktuellen Arbeiten nutzen verschiedene Zellkultursystem, Transkriptomanalyse und relevante Tiermodelle (insbesondere Maus und Drosophila melanogaster), um die Pathogenese von KEOPS-assoziierten Podozytenerkrankungen weitergehend zu entschlüsseln (DFG-Projektnummer 391152220).
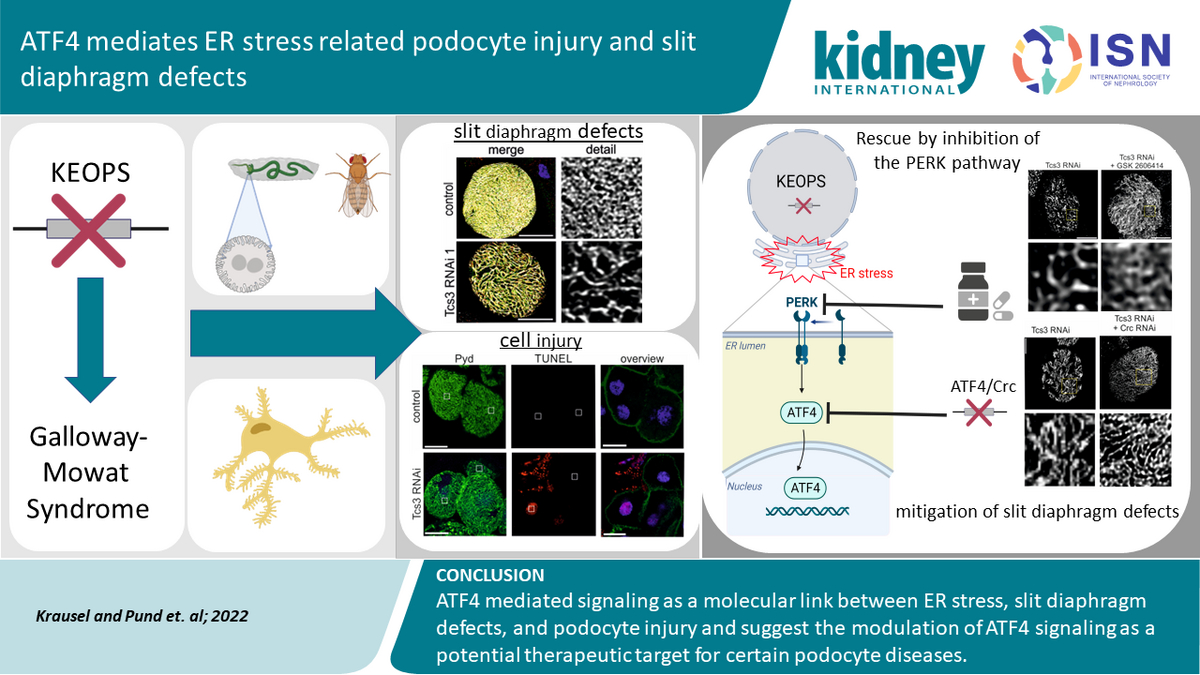
The transcription factor ATF4 mediates endoplasmic reticulum stress-related podocyte injury and slit diaphragm defects
Krausel, Vanessa und Pund, Lisanne et.al., Kidney International, December 2022
(Kidney International, 103-5, p872-885,
https://doi.org/10.1016/j.kint.2022.11.024)Punktmutationen in Proteinen der Kernpore, wie beispielsweise des Nukleoporins NUP93, als Ursache des vererbten nephrotischen Syndroms
Punktmutationen in Proteinen der Kernpore, wie beispielsweise des Nukleoporins NUP93, als Ursache des vererbten nephrotischen Syndroms
In genetischen Untersuchungen identifizierten wir Mutationen in verschiedenen Strukturproteinen der Kernpore (NUP85, NUP93, NUP107, NUP133, NUP160 und NUP205), die bei betroffenen Kindern eine früh auftretende und progredient verlaufende Nierenerkrankung auslösen, welche durch eine Podozytenschädigung, ein nephrotisches Syndrom und eine chronische Niereninsuffizienz charakterisiert ist.
Die Kernpore ist ein selektiver Transportkanal zwischen Zellkern und Zytoplasma und stellt in eukaryotischen Zellen die einzige Verbindung dieser Kompartimente dar. Die räumliche Trennung von Transkription und Translation, zweier konsekutiver Schritte bei der Überschreibung des genetischen Codes in Proteine, ist erforderlich damit Zellen auf externe Stimuli reagieren und sich an veränderte Umgebungsbedingungen anpassen können.
Diese essentielle und universelle Funktion von Kernporen in allen kerntragenden Zellen steht im Widerspruch zu unseren genetischen Beobachtungen, die einen nierenspezifischen Phänotyp bei betroffenen Patient*innen zeigen. Wir stellten daher die Hypothese auf, dass bestimmte NUP-Proteine in Podozyten eine zusätzliche, zelltyp-spezifische Funktion wahrnehmen, die unabhängig von ihrer kanonischen Rolle innerhalb der Kernpore ist. Alternativ wäre denkbar, dass Podozyten auf Grund ihres post-mitotischen Charakters besonders anfällig für Störungen der Kernporenfunktion sind.
In unserem Projekt versuchen wir diesen scheinbaren Widerspruch aufzulösen und den molekularen Krankheitsmechanismus der Kernporen-assoziierten Podozytenschädigung besser zu verstehen. Dafür haben wir Zellkultursysteme entwickelt, die neben einem induzierbaren Knockout (Genverlust) von NUP-Proteinen auch eine Visualisierung des Kerntransportes in lebenden Zellen ermöglichen (live cell imaging). Zudem untersuchen wir Mausmodelle, die den humanen Phänotyp nachstellen und somit für translationale Fragestellungen geeignet sind.

