News
Wie sich Peroxisomen „ihre“ Enzyme angeln: Forscher enthüllen die erste Struktur des Andockkomplexes
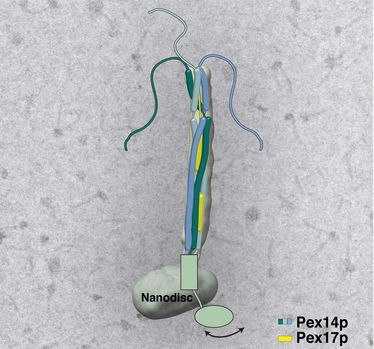
Schema des peroxisomalen Pex14pPex17p-Andock-Komplexes, dargestellt mittels Elektronen-Kryo-Mikroskopie (Abb.: Gatsogiannis)
Der Importmechanismus von Peroxisomen wird durch den Andock-Komplex Pex14pPex17p vermittelt. Der Komplex fängt wie eine Angel nahegelegene Rezeptor-Frachtkomplexe im Zytosol ein. Anschließend wird – wie genau, ist noch unklar - eine hochdynamische Pore gebildet, die die Ladung in das Peroxisomen befördert (Abb.: Gatsogiannis)
Freiburg/Bochum/Münster - Peroxisomen sind lebenswichtige membranumschlossene Organellen, die in jeder Zelle vorkommen und unter anderem für deren Entgiftung sorgen. Dafür werden sie mit einem Arsenal an Enzymen ausgerüstet. Ein Team von Wissenschaftlerinnen und Wissenschaftlern der Universitäten Freiburg, Bochum und Münster hat nun die erste Struktur des Andockapparates der Peroxisomen aufgeklärt, der Enzyme für den Transport in die Peroxisomen einfängt. Die Ergebnisse wurden in der DFG-Forschergruppe „Struktur und Funktion des peroxisomalen Translokons“ gewonnen und sind in der Fachzeitschrift „Proceedings of the National Academy of Sciences of the United States of America“ (PNAS) erschienen.
Schaut man in das Innere einer Zelle, finden sich zahlreiche Bläschen unterschiedlicher Größe. Diese sogenannten Organellen sind von einer Membran abgeschlossene Reaktionsräume, in denen bestimmte Aufgaben durch Enzyme erfüllt werden: Während in den Mitochondrien, den Kraftwerken der Zelle, Energie gewonnen wird, arbeiten in den Peroxisomen, die auch als Entgiftungsapparate der Zelle beschrieben werden, Dutzende Enzyme zum Beispiel am Abbau von schädlichen Fettsäuren oder der Synthese essentieller Lipide. Dabei fällt das giftige Wasserstoffperoxid an, das in den Peroxisomen neutralisiert wird. Defekte der Peroxisomen oder ihrer Enzyme führen zu schweren Erkrankungen mit meist tödlichen Folgen.
Signalsequenzen leiten Enzyme zum richtigen Ziel
Die meisten Organellen, wie auch die Peroxisomen, können ihre Enzyme nicht selbst bilden. Diese werden an den Ribosomen der Zelle produziert und müssen anschließend korrekt auf die jeweiligen Organellen verteilt werden. Dafür tragen die peroxisomalen Enzyme eine von zwei spezifischen Signalsequenzen, die von Importrezeptoren im Cytosol erkannt werden. Die Gruppe um Prof. Ralf Erdmann von der Ruhr-Universität Bochum konnte bereits in früheren Arbeiten zeigen, dass für jede der beiden Signalsequenzen eine extra Pore existiert, die den beladenen Rezeptor in den Innenraum der Peroxisomen schleust. „Bisher sind jedoch nur wenige Details über diesen Prozess bekannt,“ sagt Erdmann, der schon seit über 30 Jahren an Peroxisomen forscht.
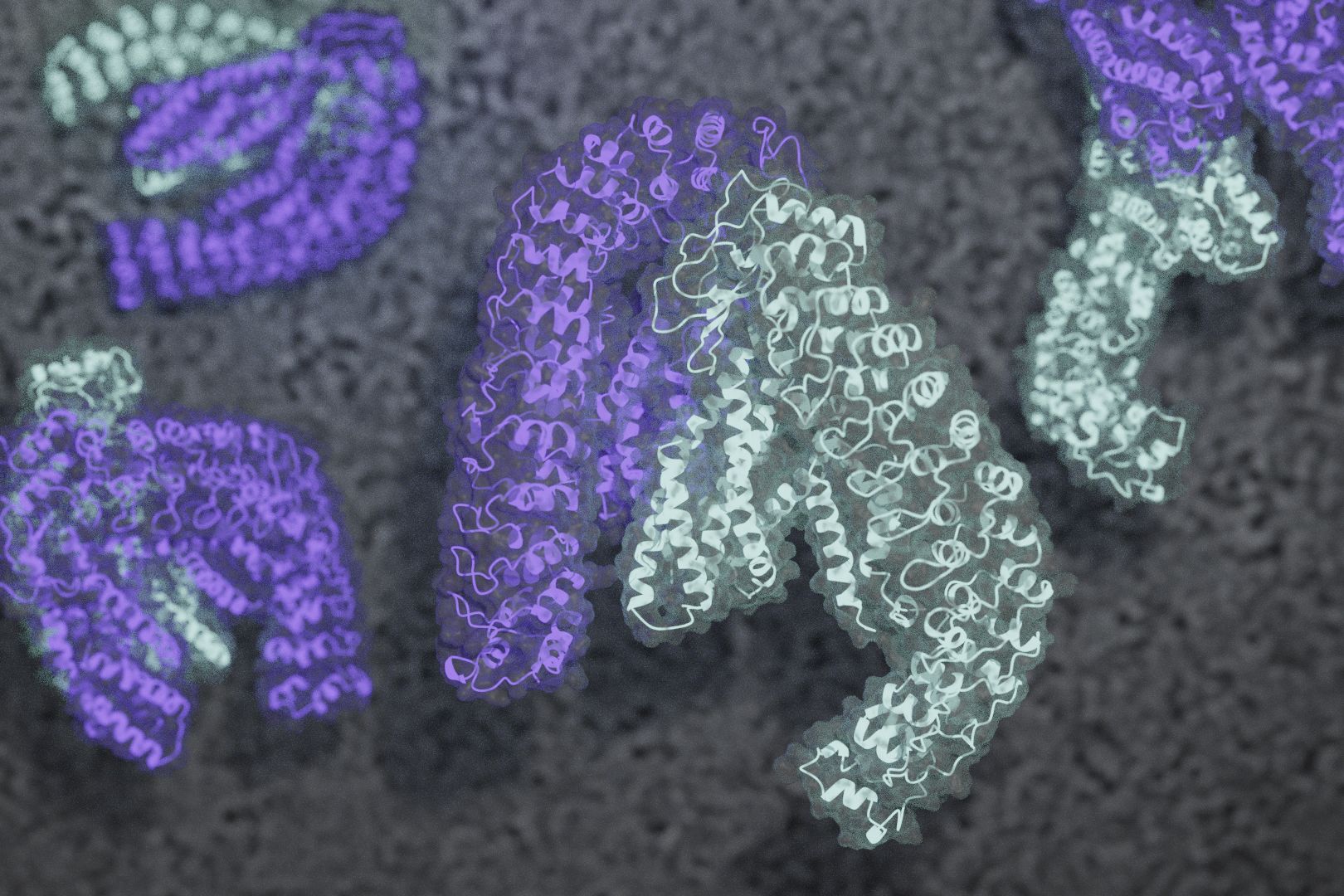
Eine zentrale Rolle wird hierbei einem Andock-Komplex zugeordnet, der die beladenen Rezeptoren zu der peroxisomalen Membran dirigiert und sie dort einfängt. Wie dieser Komplex mit Hilfe der Proteine Pex13p, Pex14p und Pex17p gebildet wird und im Detail funktioniert, ist aber noch rätselhaft. Nun ist es dem Team um Prof. Christos Gatsogiannis, vormals Gruppenleiter am Max-Planck-Institut für molekulare Physiologie in Dortmund und seit Herbst an der Universität Münster (WWU), mittels Elektronenmikroskopie erstmals gelungen, die Architektur des Komplexes zu bestimmen und so neue mechanistische Erkenntnisse zu erlangen.
Nach Enzymen angeln
Die enge Zusammenarbeit von Wissenschaftlern aus verschiedenen Fachgebieten sei der Schlüssel zum Erfolg gewesen, sind sich die Studienautoren sicher. Tobias Hansen gelang es in seiner Doktorarbeit an der RUB Bochum, einen hochreinen Komplex der Proteine Pex14p und Pex17p zu isolieren. Mit nativer Massenspektrometrie konnte Daniel Wendscheck, Doktorand in Freiburg, feststellen, dass sich der Komplex insgesamt aus drei Kopien des Proteins Pex14p und einem Pex17 zusammensetzt. Pascal Lill, Doktorand am MPI in Dortmund, rekonstituierte den Andock-Komplex in einer nahezu nativen Membranumgebung, um die Bedingungen an der peroxisomalen Membran zu simulieren und gewann mit Hilfe der Kryo-Elektronenmikroskopie und -tomographie die Struktur des Komplexes. Diese zeigt längliche, parallel zueinander angeordnete Stränge, die zusammen eine stabähnliche Gesamtstruktur ausbilden.
Dieser „Stab“ schaut mit etwa zwei Dritteln aus den Peroxisomen heraus. Durch weitere Experimente konnten die drei Gruppen schließlich auch die genaue Anordnung der Proteine aufklären. Am Ende der Struktur zeigen die drei Pex14p-Proteine flexible Bereiche, die wie Tentakel in den Raum der Zelle herausragen. Die Wissenschaftler vermuten, dass die Fangarme dazu dienen, möglichst viele beladene Rezeptoren zu angeln.
Prof. Gatsogiannis erklärt: „Dieser Komplex ist von essentieller Bedeutung für funktionstüchtige Peroxisomen. Unser erstes Bild seiner Struktur und ein mechanistisches Modell seiner Funktion bilden eine wichtige Grundlage für weitere Untersuchungen der Peroxisomen und könnten auch zu einem besseren Verständnis peroxisomaler Krankheiten beitragen.“ Gatsogiannis hat im September einen Ruf auf die Professur für Elektronen-Tomographie nanostrukturierter Systeme am Institut für Medizinische Physik und Biophysik der Medizinischen Fakultät in Münster angenommen. Er wird bald seine Gruppe am neuen „Center for Soft Nanoscience“ der WWU etablieren.