News
Ewing-Sarkom: Forschungsgruppe entdeckt einen „Hebel“ zum Stoppen des Tumorwachstums
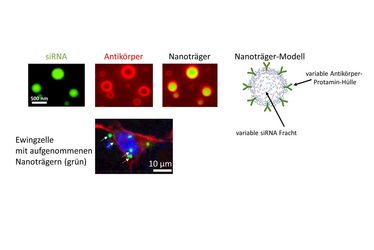
Oben: Der von der Forschungsgruppe etablierte Nanoträger besteht aus siRNA (grün), die an Protamin komplexiert ist. Der Nanoträger ist mit Antikörpern dekoriert (rot). Das Modell zeigt die Nanoträgerstruktur schematisch. Unten: Zur Therapie von Ewing-Sarkomen werden entsprechend angepasste Nanoträger in die Tumorzellen aufgenommen (rot: Zellgerüst, blau: Zellkern, grün: siRNA in Nanoträger) (Abb.: WWW / S. Bäumer)
Münster (wss/mfm) – Mit einer Häufigkeit von 2 bis 2,4 von einer Million bei Kindern und jungen Erwachsenen zählen Ewing-Sarkome zu den seltenen Erkrankungen. Zugleich sind diese Knochentumoren hoch aggressiv: Obwohl sich das Gesamtüberleben für 70 Prozent der Erkrankten in den letzten Jahren durch Kombinationen von Operation, Bestrahlung und Chemotherapie stark verbessert hat, verstirbt etwa ein Drittel der Patienten mit Metastasen innerhalb der ersten fünf Jahre nach Diagnose. Auf Seiten der Pharma-Industrie ist das Interesse an seltenen Erkrankungen gering und das Engagement der universitären Forschung somit umso wichtiger. An der Westfälischen Universität (WWU) Münster hat sich eine Arbeitsgruppe um Prof. Wolfgang Berdel und Dr. Sebastian Bäumer vorgenommen, neue Therapieoptionen zu entwickeln. Sie kombiniert die Nobelpreis-gewürdigten Methoden der Immuntherapie und RNA-Interferenz – und hat so einen interessanten Ansatz entdeckt.
Ursache für das Wachstum eines Ewing-Sarkoms ist eine genetische Veränderung, die die Bildung eines sogenannten Fusionsproteins EWS-FLI1 hervorruft. Dieser neue Faktor verändert die Zellen so, dass sie ungehemmt wachsen. Im Labor konnte dieser Faktor und damit das Wachstum der Ewing-Tumorzellen bereits gehemmt werden. Beim Patienten gelang dies bislang aber nicht - der Faktor EWS-FLI1 galt als „unangreifbar“.
2005 ging der Nobelpreis für Medizin an die beiden Forscher Craig Mello und Andrew Z. Fire für ihre Entdeckung, dass kleine RNA-Moleküle die Vorlage von jeglichen Proteinen in der Zelle, die mRNA, hemmen können. In die Anwendung dieser „small interfering RNAs“ (siRNAs) wurde und wird große Hoffnung gesetzt, da mit ihnen bislang unangreifbare Faktoren stillgelegt werden können - wie EWS-FLI1 aus den Ewing-Tumorzellen. Weil siRNAs aber nicht spontan von Zellen aufgenommen und zudem rasch in der Blutzirkulation abgebaut werden, suchen viele Forschungsgruppen mit Hochdruck nach einer Lösung, wie sich siRNAs sicher und effektiv in Zellen transportieren lassen.
Hemmung des Tumorwachstums ohne Anzeichen von Nebenwirkungen
Um die siRNA vor einem unerwünschten Abbau in der Blutzirkulation zu schützen, wurde sie in einen Nanoträger aus Protamin, einem körpereigenen Spermiumprotein, verpackt. Zudem umgaben die beiden Forscher aus Münster diese Nanoträger mit Antikörpern gegen ein Oberflächenmolekül von Ewing-Tumorzellen. So können sich die Antikörper mitsamt dem Protamin und den siRNAs gegen das EWS-FLI1 an die Einwegzelle binden und sogar aufgenommen werden. Innerhalb der Zelle verhindern die siRNAs dann die Produktion von EWS-FLI1 und entziehen so den Ewing-Tumorzellen die Grundlage für ihr ungehemmtes Wachstum.
Im Mausmodell konnte die Forschungsgruppe bereits nachweisen, dass das Wachstum von Ewing-Tumorzellen nach Injektion mit dem Nanoträger samt Fracht stark eingeschränkt wurde, ohne dass die Tiere Anzeichen von Nebenwirkungen hatten. So kann davon ausgegangen werden, dass sich die Wirkung der siRNAs gegen EWS-FLI1 wie erhofft und erwartet auf die Ewing-Sarkomzellen beschränkt. Dies ist ein bedeutsamer Unterschied zu sonstigen Chemotherapeutika, die prinzipiell in alle Körperzellen aufgenommen werden können. EWS-FLI1 befindet sich nur in den Ewing-Tumorzellen und nur diese Zellen sind von seiner Anwesenheit abhängig. Damit kann die siRNA gegen EWS-FLI1 auch bei unbeabsichtigter Aufnahme in Nicht-Ewing-Tumorzellen voraussichtlich keinen Schaden anrichten und wird schnell vom Körper abgebaut.
Der Forschungsgruppe gelang es, ihre Ergebnisse durch Anpassung der siRNA und des Antikörpers auf andere Krebsarten wie Lungen- oder Blutkrebs auszuweiten. Die RNA-Interferenz kann nun therapeutisch angewendet werden, indem das System modular auf die Bedürfnisse anderer Tumorerkrankungen oder gänzlich anderer Erkrankungen übertragen wird. So ist eine Plattform für die Entwicklung weiterer molekularer und personalisierter Therapieoptionen entstanden. Gefördert wurde das münstersche Forschungsprojekt mit rund 250.000 Euro von der Wilhelm-Sander-Stiftung. Ihr Satzungszweck ist die Förderung der medizinischen Forschung, insbesondere von Projekten der Krebsbekämpfung. Mit einer Ausschüttung von bereits über 250 Millionen Euro zählt die Einrichtung zu den bedeutendsten privaten Forschungsstiftungen im deutschen Raum.