Synapsen unterscheiden sich hinsichtlich ihrer physiologischen Eigenschaften teilweise sehr stark voneinander. Da beispielsweise die Freisetzungswahrscheinlichkeit von synaptischen Vesikeln sogar zwischen Terminalen desselben Neurons in Abhängigkeit vom postsynaptischen Partner variieren kann, interessieren wir uns für das Problem wie Funktion und Struktur von Synapsen reguliert werden. Unsere Arbeitshypothese ist dabei, dass synaptische Zelloberflächenmoleküle wie Neurexine und ihre vielfältigen präsynaptischen und postsynaptischen Bindungspartner (Neuroligine, LRRTMs, Cerebelline, Dystroglycan, Neurexophiline, etc.) in diesem Prozess eine wichtige Rolle spielen.
Tatsächlich sind Neurexine nach Analysen in verschiedensten Mausmutanten wichtig für eine effektive Ca2+-abhängige Transmission in vielen exzitatorischen und inhibitorischen Neuronen. Möglicherweise “übersetzen” solche Zelladhäsionsmoleküle die Erkennung von Partnerzellen in die jeweiligen Eigenschaften der synaptischen Transmission. Da Neurexine und ihre Interaktionspartner in einer grossen Variantenzahl auftreten, wären sie im Sinne eines transsynaptischen Codes geeignet, die präsynaptische Freisetzung von Transmittern und/oder die postsynaptische Verfügbarkeit von Rezeptoren in zell- oder gar synapsenspezifischer Weise zu regulieren.
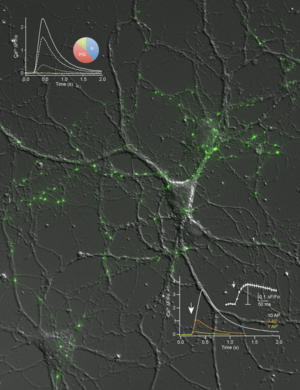
Aktuell beschäftigt uns besonders die Frage wie Neurexine die Ca2+-abhängige Vesikelfreisetzung beeinflussen. Wir haben experimentelle Hinweise gewonnen, dass die hochspannungsabhängigen Kalziumkanäle in diesem Prozess involviert sind. So ist beispielsweise der präsynaptische Ca2+-Einstrom in Neurone, denen bestimmte Neurexinvarianten fehlen, stark reduziert und der Beitrag verschiedener Kalziumkanal-Subtypen (Cav2.1, Cav2.2, etc.) verändert. Eine Beteiligung dieser Kanäle scheint plausibel, da die Freisetzungswahrscheinlichkeit von synaptischen Vesikeln stark vom Ca2+ Einstrom abhängt und kleine Veränderungen zu großen Effekten auf die Transmission führen. Zukünftig möchten wir daher versuchen, den molekularen Mechanismus dieser Regulation genauer aufzuklären.

