piRNA Pathway (AG Stallmeyer)
Neue Krankheitsgene für männliche Unfruchtbarkeit: Konsequenzen eines gestörten piRNA-Signalwegs in männlichen Keimzellen und weitere genetische Ursachen
Die Ursachen für eine gestörte Spermatogenese, die zu männlicher Infertilität führt, sind oft schwer zu ergründen. Es wird jedoch davon ausgegangen, dass genetische Faktoren eine wichtige Rolle bei der Erkrankung spielen. In unseren Projekten wollen wir neue genetische Ursachen für die Krankheit identifizieren und funktionell charakterisieren, wobei wir uns besonders auf Gene konzentrieren, von denen man annimmt, dass sie am piRNA-Signalweg beteiligt sind oder auf den menschlichen Geschlechtschromosomen liegen.
Mutationen in Genen des piRNA-Signalwegs als Ursache führen zu Azoospermie
Über die Folgen des Funktionsverlusts von Genen des piRNA-Signalwegs bei Männern auf die Spermatogenese ist wenig bekannt, und das genaue Expressionsmuster und die subzelluläre Lokalisierung der kodierten Proteine wurden noch nicht systematisch analysiert. Daher wollen wir unfruchtbare Männer mit biallelischen, potenziell pathogenen Varianten in Genen, die an der piRNA Biogenese beteiligt sind, identifizieren und die Folgen des dysfunktional kodierten Proteins auf die piRNA-Generierung sowie auf nachgeschaltete piRNA-vermittelte keimzellspezifische Funktionen analysieren.
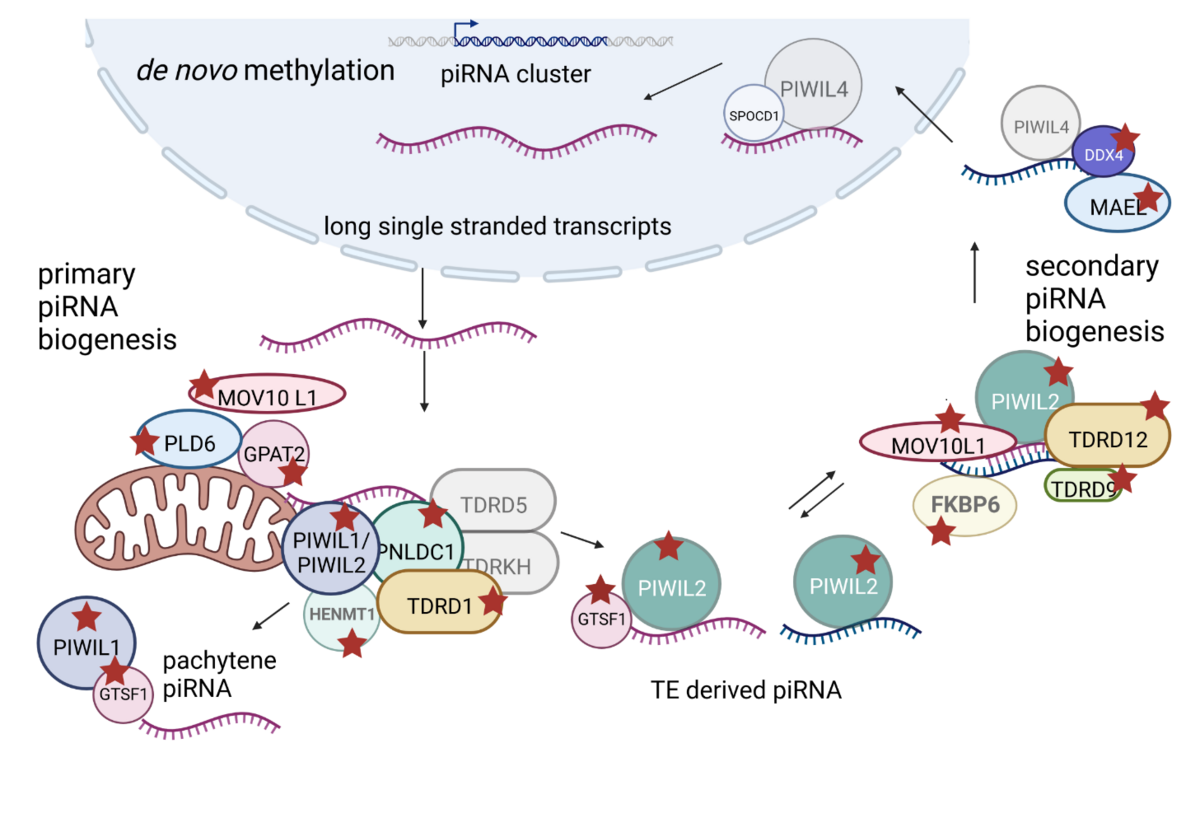
Identifizierung von geschlechtschromosomal vererbten Krankheitsgenen für männliche Unfruchtbarkeit
Die Geschlechtschromosomen (X und Y) sind für die Fruchtbarkeit des Mannes von entscheidender Bedeutung, da sie mehrere Gene enthalten, die für die Geschlechtsbestimmung und die Fortpflanzungsfunktion wesentlich sind. Die geschlechtschromosomalen keimzellenspezifischen Gene sind für die Erforschung der männlichen Unfruchtbarkeit besonders interessant, da pathogene Varianten in diesen Genen bei Männern im Gegensatz zu autosomal rezessiven Mutationen nicht durch ein normales Allel maskiert werden können. Auf dem menschlichen Y-Chromosom sind die Gene in den AZF-Regionen, neben dem Geschlechtsbestimmungsfaktor SRY, nachweislich für eine ordnungsgemäße Spermatogenese unerlässlich. Die krankheitsverursachenden Gene innerhalb dieser Regionen sind jedoch nach wie vor unklar. Durch das Screening der Exom-Sequenzierungsdaten der MERGE-Kohorte auf seltene genetische Varianten in Genen mit hodenspezifischer Expression wollen wir neue geschlechtschromosomale Gene identifizieren, die mit der Krankheit in Verbindung stehen. Als erstes Ergebnis konnten wir nachweisen, dass das Gen DDX3Y der wichtigste spermatogene Faktor innerhalb der Y-chromosomalen AZFa-Region ist.
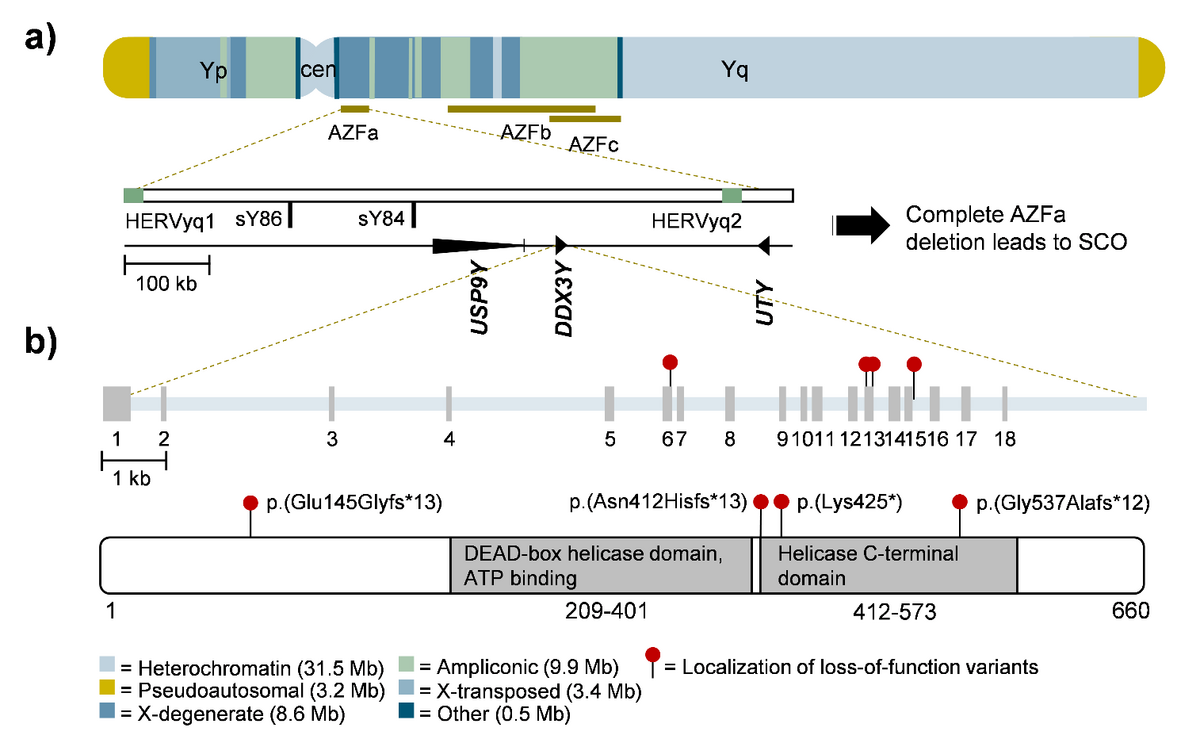
Perspektivisch haben unsere Projekte das Ziel, den Anteil der diagnostisch ungeklärten männlichen Unfruchtbarkeit weiter zu reduzieren. Durch eine eingehende funktionelle Charakterisierung der identifizierten, potenziell pathogenen Varianten wird das Projekt auch das Wissen über die zellulären Funktionen der jeweiligen Krankheitsgene erweitern. Die Charakterisierung der klinischen Phänotypen liefert zudem Informationen über die Chancen des Patienten, mit Hilfe von Techniken der assistierten Reproduktion, wie der In-vitro-Spermienextraktion und der intrazytoplasmatischen Injektion, ein Kind zu zeugen.


