Peroxisomale Biogenese
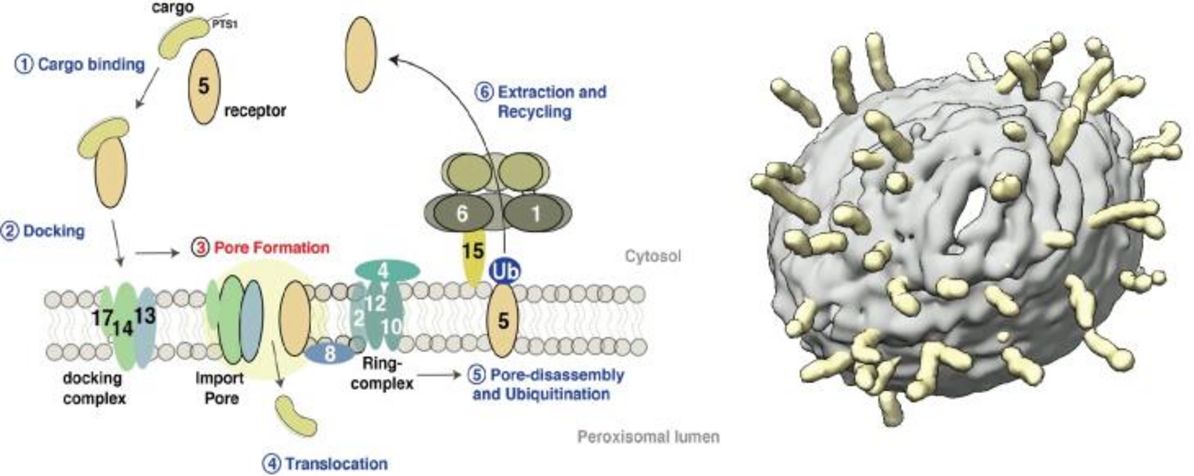
Import von peroxisomalen Matrixproteinen. Dargestellt ist ein allgemeines Modell des PTS1-Importweges (linkes Bild). cryoEM-Tomographie des in Liposomen rekonstituierten peroxisomalen Andockkomplexes (rechtes Bild; aus Lill et al., 2020, PNAS) Unsere Forschung konzentriert sich auf das molekulare Verständnis der peroxisomalen Biogenese. Peroxisomen sind dynamische kleine Organellen, die in fast allen Eukaryoten vorkommen. Sie sind in der Lage, eine Fülle von entscheidenden Stoffwechselfunktionen zu übernehmen, darunter die β-Oxidation von Fettsäuren und der Abbau von toxischem Wasserstoffperoxid. Die entsprechenden Enzyme werden auf freien zytoplasmatischen Ribosomen synthetisiert und später durch die peroxisomale Importmaschinerie in das peroxisomale Lumen importiert. Peroxisomale Dysfunktion und gestörter peroxisomaler Import führen zu verheerenden, angeborenen Stoffwechselstörungen, was die Bedeutung des Verständnisses dieser grundlegenden biologischen Fragen weiter unterstreicht. Nebenbei geraten die Peroxisomen als Signalplattformen immer weiter in den Fokus aktueller Forschung und spielen unter anderem eine essentielle Rolle in der angeborenen Immunantwort. Des weiteren werden Peroxisomen eine Rolle in einer vielzahl Alters-Assoziierten Erkrankungen, u.a. in Krebs, Neurodegenerativen Prozessen und Diabetes.
Die Hauptcharakteristika des peroxisomalen Importprozesses sind jedoch nach wie vor nur unzureichend verstanden. Unsere Forschung zielt darauf ab, diese Prozesse mittels KryoElektronenmikroskopie (Einzelpartikelanalyse und Tomografie) und biochemische und biophysikalische Methoden zu charakterisieren and visualisieren, um diesen zentralen Mechanismus im Detail zu verstehen.
AAA-ATPasen: Biologische Nanomaschinen
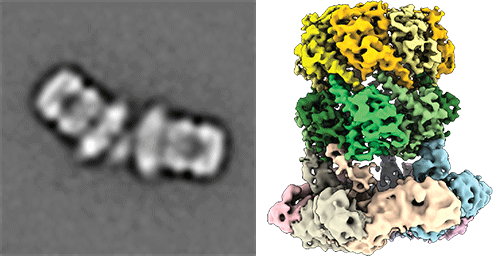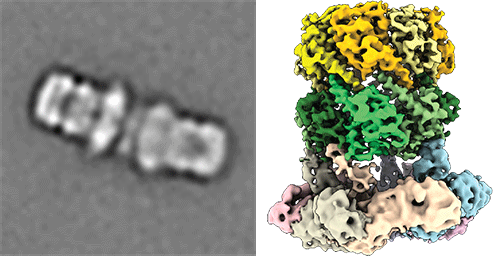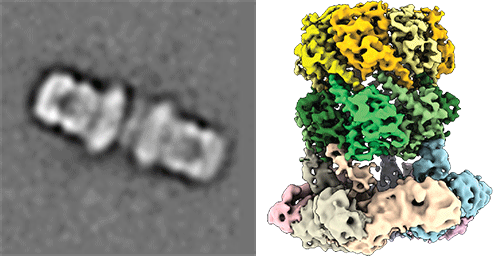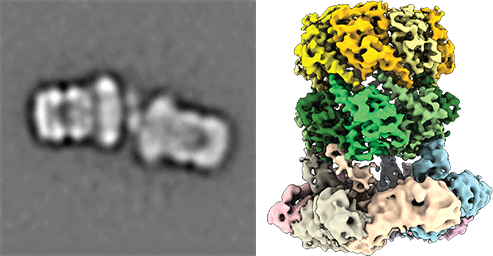
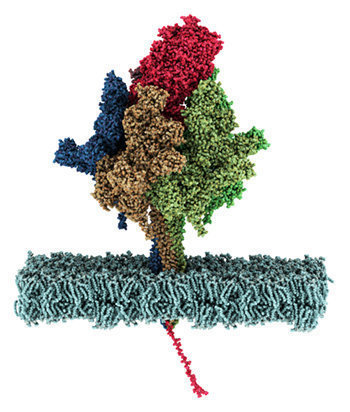
Kryo-elektronenmikroskopisches Bild des Komplexes aus ClpP und ClpX, der in pathogenen Bakterien fuer den Abbau nich mehr benoetigter Proteine sorgt (aus Gatsogiannis, Balogh et al., 2019; Nature Strut Mol Biol) Proteinqualitätskontrollsysteme sind wichtig für die Regulation des Gleichgewichts des zellulären Proteoms. Dabei wird die Aktivität und der Faltungszustand von Proteinen in allen Zellen präzise kontrolliert und reguliert, insbesondere im Zusammenhang u.a. von Stressantworten, Zellteilung und Virulenz von pathogenen Mikroorganismen. AAA+ Proteasekomplexen spielen dabei eine zentrale Rolle. Ringförmiger AAA ATPasen nutzen einerseits die Energie aus der ATP-Hydrolyse, um Substratproteine energieabhängig zu entfalten. Die entfaltete Proteine können z.B. an Proteasen für den weiteren Abbau weitergeleitet oder an anderen Kompartmenten recyclet werden.
Wir möchten die strukturelle Konformationsdynamik dieser faszinierender molecularer Maschinen in Aktion erhalten und auch Ihren Interaktionsnetzwerk in Ihre native Umgebung direkt visualisieren. Nur dann können deren Funktionsweise in Detail aufklären und somit eine solide Basis für die Bekämpfung schwerer Störungen und Krankheiten schaffen, die auf molekulare Defekte dieser Maschinen zurückuführen sind.
Porenbildende Neurotoxine
Das bakterielle Porenbildende Tc-Toxin (aus Gatsogiannis, Lang et al., Nature 2013; Meusch, Gatsogiannis et al., Nature 2014; Gatsogiannis et al. Nature Struct Mol Biol 2016; Gatsogiannis et al. Nature, 2018) Porenbildende Proteine stellen eine einzigartige Klasse von hochspezifischen lipidbindenden Proteinen dar, die eine ausgeklügelte Metamorphose von einer löslichen Präpore zu einem transmembranen Porenstatus durchlaufen. Wir sind besonders daran interessiert, die zugrundeliegenden Mechanismen derjenigen porenbildenden Proteine zu verstehen, die in der Lage sind, sich auf regulierte Weise in Membranen einzufügen.
Wir sind vor allen an grossmolekulare Neurotoxine interessiert, welche an speziellen Rezeptoren an der präsynaptische Membran binden, darauffolgend in die Membran inserieren und eine massive Freilassung von Neurotransmitter induzieren.
Methodenetablierung

Die Entwicklung neuartiger Reagenzien, einschließlich Nanodiscs und Amphipolen, hat funktionelle und strukturelle Studien von integralen Membranproteinen (IMPs) erheblich erleichtert. Wir sind daran interessiert, neuartige und delikate Methoden mit Hilfe der DNA-Origami-Technologie zu entwickeln, um die Probenqualität von IMPs für hochauflösende Strukturanalysen mittels CryoEM zu optimieren.
Gefördert durch:

Bisherige Förderung:
- 2016-2020: DFG-funded Research Group "PerTrans"
- 2018: JSPS, Uehara Foundation

