Schwerpunkte
Bedeutung von Annexin A4 für die kardiale Funktion
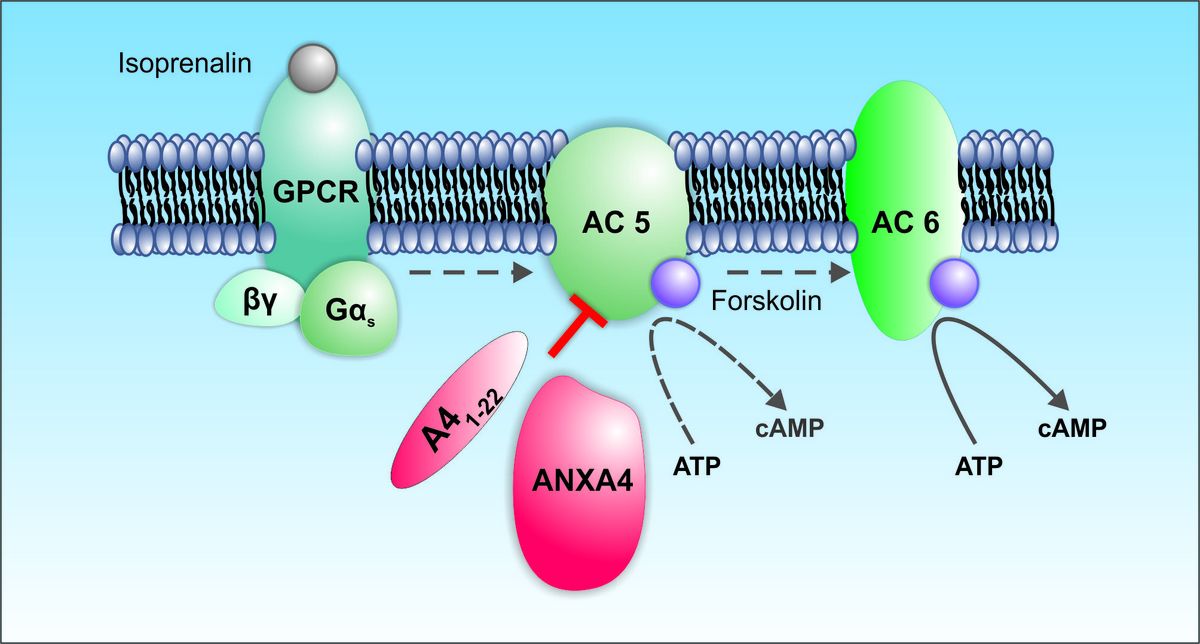
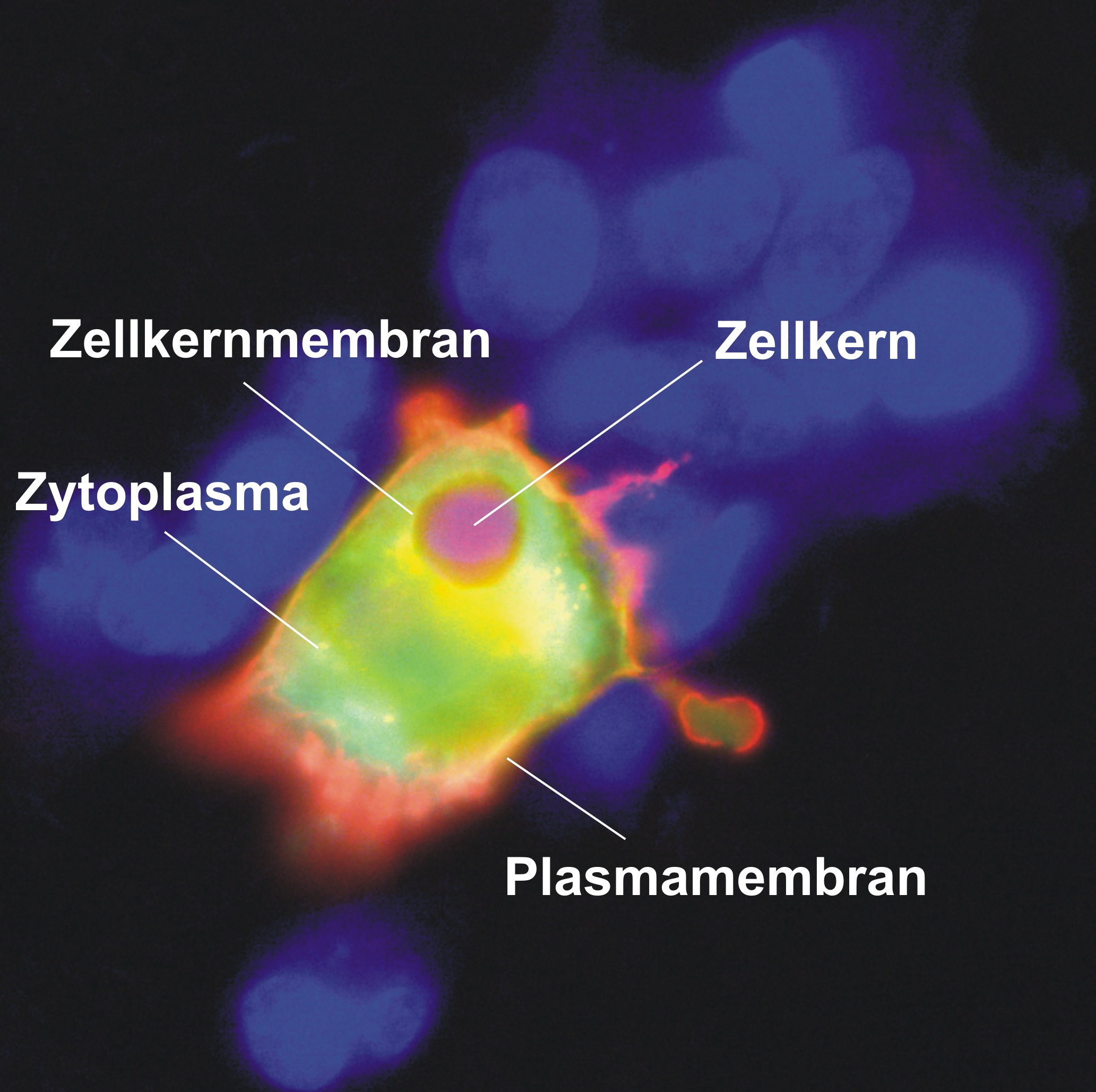
Signalweg Annexin A4 Annexin A4 (ANXA4) ist ein Kalzium- und Phospholipid-bindendes Protein, welches bei humaner Herzinsuffizienz hochreguliert wird. Bislang ist unbekannt, ob dies einen protektiven und kompensatorischen Mechanismus darstellt. In Co-Immunpräzipitations-Experimenten in human emryonic kidney cells (HEK293) konnten wir zeigen, dass es zu einer direkten Interaktion von ANXA4 mit der membrangebundenen Adenylylcyclase 5 (AC5) kommt. Adenylylcyclasen sind essenziell für die reguläre aber auch pathophysiologische Signalantwort von Kardiomyozyten und katalysieren die Umwandlung von Adenosintriphosphat (ATP) zu zyklischem Adenosinmonophosphat (second messenger cAMP). Eine Überexpression von ANXA4 in HEK293 Zellen nach Stimulation ging einher mit einer verminderten cAMP Produktion, wohingegen eine Inaktivierung von ANXA4 in Mäusen einherging mit einer erhöhten cAMP Produktion. Somit fungiert ANXA4 wohl als Inhibitor der AC5.
In Kardiomyozyten gibt es zwei prädominante AC-Isoformen, die AC5 und die AC6. Eine spezifische AC5 Inhibition gilt als eine neue Option zur Behandlung der Herzinsuffizienz mit möglichen Vorteilen gegenüber einer Behandlung mit β-Adrenozeptor-Inhibitoren (β-Blocker). Wir konnten bereits in HEK293 Zellen zeigen, dass ANXA4 über seinen N-Terminus spezifisch nur mit AC5 interagiert und nicht mit AC6. Ein synthetisches Peptid bestehend aus der N-terminalen Sequenz von ANXA4 (A4N1-22) verminderte nach Stimulation ebenfalls die cAMP Produktion in AC5- aber nicht in AC6-exprimierenden HEK293 Zellen. In ANXA4-defizienten Mäusen führte die β-AR Stimulation aufgrund der dort fehlenden AC5 Inhibition zur Erhöhung des L-Typ Kalziumkanal Stroms und zu einer ausgeprägten Aktionspotential-Verlängerung in Kardiomyozyten. Nach Zugabe des synthetischen A41-22 Peptids konnte diese verstärkte Antwort, wahrscheinlich durch die dann verursachte spezifische Inhibition der AC5, wieder aufgehoben werden. ANXA4 inhibiert somit über seine N-terminale Domäne spezifisch AC5 und nicht AC6. Das synthetische A41-22 Peptid (Patentanmeldung „Specific AC5 inhibitor“ PCT/EP2017/076839) könnte somit als spezifischer AC5 Inhibitor einen neuen therapeutischen Ansatz für die Behandlung von AC5-verbundenen Krankheiten darstellen.
Ansprechpartner:
Dr. rer. nat. Alexander HeinickAnnexin A4 N‑terminal peptide inhibits adenylyl cyclase 5 and limits β‑adrenoceptor-mediated prolongation of cardiac action potential
Heinick A, Pluteanu F, Hermes C, Klemme A, Domnik M, Husser X, Gerke V, Schmitz W, and Müller FU. The FASEB Journal. (2020) DOI: 10.1096/fj.201902094RRAnnexin A4 is a novel direct regulator of adenylyl cyclase 5
Heinick A, Husser X, Kirchhefer U, Nunes F, Schulte JS, Seidl MD, Rolfes C, Dedman JR, Kaetzel MA, Gerke V, Schmitz W, and Müller FU. The FASEB Journal. (2015) DOI: 10.1096/fj.14-269837Chronic -adrenergic stimulation reverses depressed Ca handling in mice overexpressing inhibitor-2 of protein phosphatase 1
Kirchhefer U, Hammer E, Heinick A, Herpertz T, Isensee G, Müller FU, Neumann J, Schulte JS, Schulte K, Seidl MD, Boknik P. Journal of Melecular and Cellular Cardiology (2018) DOI: 10.1016/j.yjmcc.2018.10.022Arrhythmogenes Remodeling
Text folgt.
Bedeutung cAMP-abhängiger Transkriptionsfaktoren im kardiovaskulären System
 Pathophysiologische Veränderungen im kardialen Remodeling gehen mit einer veränderten Regulation der Genexpression einher. Klinische und experimentelle Daten führten zu der Hypothese, dass eine Aktivierung des cAMP-abhängigen Signalweges durch eine chronische Stimulation des β-Adrenozeptors durch vermehrt ausgeschüttete Katecholamine wesentlich zu der veränderten Genregulation im insuffizienten Herzen beiträgt. Ziel unserer Untersuchungen ist es ein besseres Verständnis von pathophysiologisch relevanten Mechanismen der kardialen Genregulation zu erlangen und Mechanismen zu untersuchen die günstig in die gestörte Regulation der Genexpression im insuffizienten Herzen eingreifen.
Pathophysiologische Veränderungen im kardialen Remodeling gehen mit einer veränderten Regulation der Genexpression einher. Klinische und experimentelle Daten führten zu der Hypothese, dass eine Aktivierung des cAMP-abhängigen Signalweges durch eine chronische Stimulation des β-Adrenozeptors durch vermehrt ausgeschüttete Katecholamine wesentlich zu der veränderten Genregulation im insuffizienten Herzen beiträgt. Ziel unserer Untersuchungen ist es ein besseres Verständnis von pathophysiologisch relevanten Mechanismen der kardialen Genregulation zu erlangen und Mechanismen zu untersuchen die günstig in die gestörte Regulation der Genexpression im insuffizienten Herzen eingreifen.
In diesem Zusammenhang ist die Untersuchung der Bedeutung der cAMP-abhängigen Transkriptionsfaktoren „cAMP response element binding protein“ (CREB), „cAMP response element modulator“ (CREM) sowie „activating transcription factor 1“ (ATF1) sowie davon regulierter Zielgene ein Schwerpunkt der Forschungsaktivitäten des Instituts. Diese Faktoren sind strukturell verwandt und vermitteln eine cAMP-abhängige Genregulation, die u.a. für die Kontrolle von Apoptose und Proliferation von Zellen Bedeutung ist.
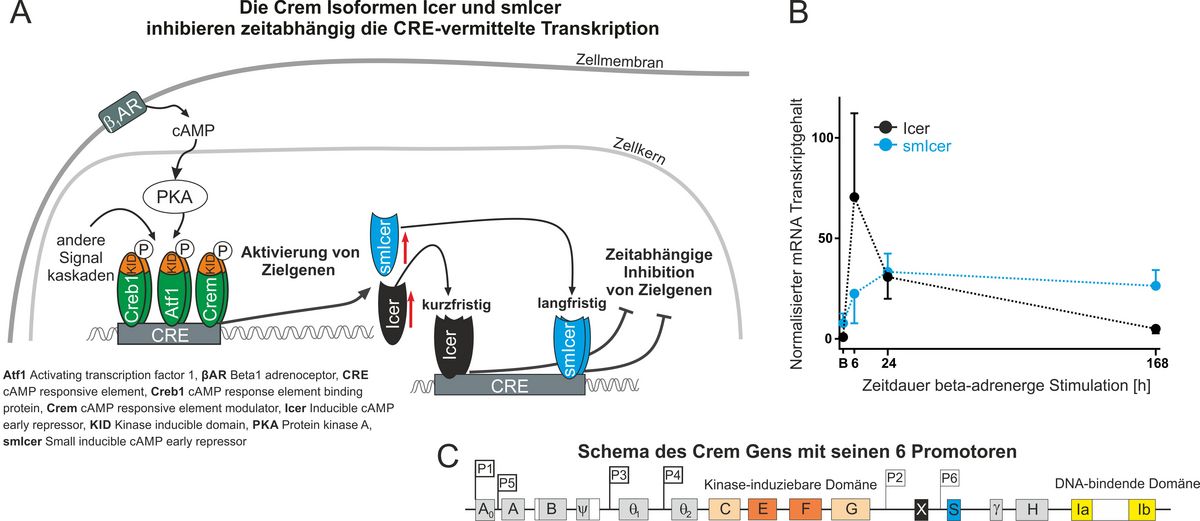
Insbesondere untersuchen wir die kurzen CREM Isofomen inducible cAMP early repressor (ICER), die im CREM-Gen durch den ICER-spezifischen P2 Promoter induziert werden. ICER wird durch verschiedene äußere Reize wie z.B. beta-adrenerge Stimulation schnell induziert und gilt als negativer Regulator der kardialen Hypertrophie und als positiver Mediator der Apoptose (Fig. A).
Des weiteren konnten wir einen weiteren internen Promotor (P6) innerhalb des Crem-Gens identifizieren. Dieser Promotor kodiert kurze transkriptionshemmende Isoformen, die als kleine ICER (smICER) Proteine bezeichnet werden, wie längerfristig nach beta adrenerger Stimulation induziert werden (Fig. B, C). Die langfristige Induktion des Transkriptionsfaktors smICER könnte einen wichtigen Mechanismus darstellen, um das genetische Programm von kardialen Myozyten in pathophysiologischen dauerhaft zu modulieren.Während das Wissen über die spezifische funktionelle Rolle der smICER-Isoformen im Herzen und anderen Geweben noch recht spärlich ist, ist mehr über die Funktionen von CREM-IbC-X, einer aus menschlichem Herzgewebe isolierten weiteren Crem Isoform, bekannt. Die von CREM-IbC-X mRNA codierten Proteine sind identisch mit Proteinen, die ebenfalls von einigen smICER-Spleißvarianten kodiert werden. Eine Überexpression von CREM-IbC-X im Herzen, zeigt einen komplexen kardialen Phänotyp mit strukturellen Veränderungen im Vorhof, die zu spontanem Vorhofflimmern führen.
Neben der kardialen Rolle von CREB/CREM/ATF1-Transkriptionsfaktoren, wird in weiteren Projekten auch deren Bedeutung für die Pathophysiologie gefäßproliferativer Erkrankungen untersucht.AnsprechpartnerMatthias SeidlBedeutung regulatorischer Untereinheiten der PP2A im Herzen
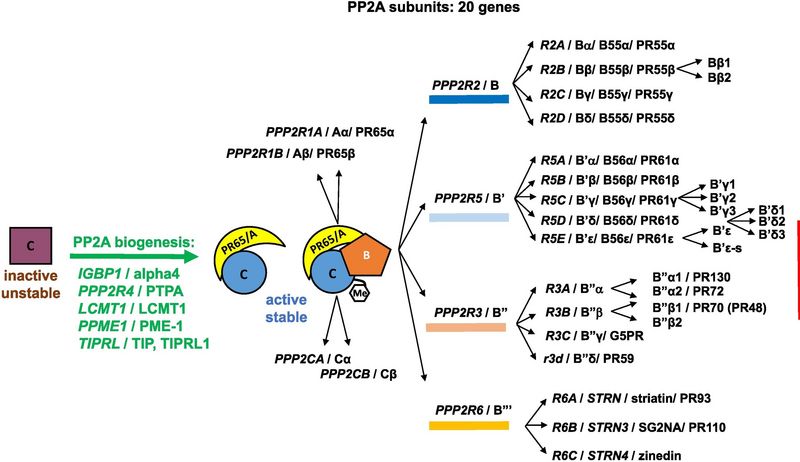
Das PP2A-Holoenzym ist ein aus katalytischer (C), struktureller (A) und regulatorischer (B) Untereinheit bestehendes Heterotrimer. Die regulatorische Untereinheit ist wiederum aus mehreren Genfamilien aufgebaut (aus Reynhout & Janssens 2019). Die reifen Genprodukte fungieren als Phosphoproteine und können teilweise Ca2+ binden.
Seit Mitte der 90er Jahre bilden Studien zur funktionellen Rolle von Serin/Threonin-Proteinphosphatasen im gesunden und kranken Herzen einen Schwerpunkt des Instituts. Bedeutende Fortschritte wurden dabei in der Untersuchung von natürlichen und synthetischen Proteinphosphatase-Hemmstoffen als potentielle Therapeutika einer Herzinsuffizienz gemacht. In genetisch veränderten Tiermodellen wurden ergänzend die biochemischen und funktionellen Auswirkungen einer Überexpression oder Herabregulation endogener Inhibitoren von Proteinphosphatasen gemessen.
Im letzten Jahrzehnt rückte die Proteinphosphatase 2A (PP2A) mehr und mehr in den Blickpunkt unseres wissenschaftlichen Interesses. So konnten wir zeigen, dass die PP2A die myofilamentäre Ca2+-Sensitivität in nicht-insuffizienten menschlichen Herzen steigert (Wijnker et al. 2011). Ihre vielfältigen zellulären Funktionen, wie Substratspezifität und Targeting, werden durch die große Anzahl regulatorischer Untereinheiten erklärt (s. Abbildung). Weitestgehend unklar ist bisher, wann welche Trigger einzelne regulatorische Untereinheiten und somit die substratspezifische PP2A aktivieren. Dieser Frage gehen wir unter Anwendung biochemischer, zellbiologischer und pharmakologischer Methoden nach.
Durch die experimentellen Arbeiten der letzten Jahre konnten wir beispielsweise zeigen, dass die im Herzen exprimierte Hauptform der B‘-Familie, B56α, durch die Proteinkinase C an Serin-41 phosphoryliert und dadurch gehemmt wird (Kirchhefer et al. 2014a). Eine vermehrte Expression von B56α in den Kardiomyozyten steigert die Dephosphorylierung myofilamentärer Proteine und über eine Erhöhung der Ca2+-Sensitivität schließlich die Kontraktilität (Kirchhefer et al. 2014b).
Derzeit hat sich unsere Forschung auf die Untersuchung der B‘‘-Familie verschoben. Die Mitglieder dieser Genfamilie können über sogenannte EF hands Ca2+ binden. Es ist zu vermuten, dass über diese Eigenschaft sowohl kurzfristige als auch chronische Effekte auf die Herzfunktion und/oder –struktur verrichtet werden. Eine pharmakologische Beeinflussung der Ca2+-Bindung könnte protektive Auswirkungen auf die Herzfunktion besitzen.
Ansprechpartner: Uwe Kirchhefer
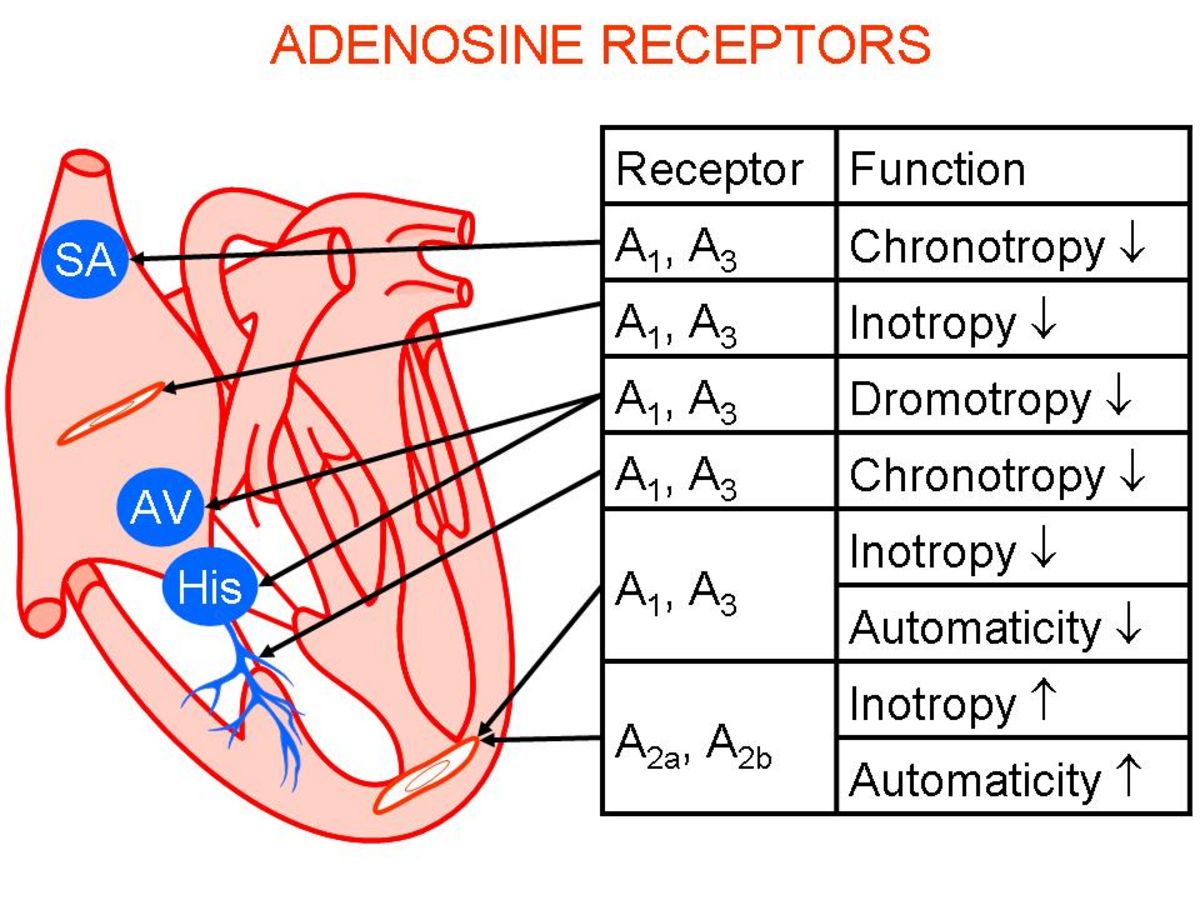
Kardiale Bedeutung von Adenosinrezeptoren
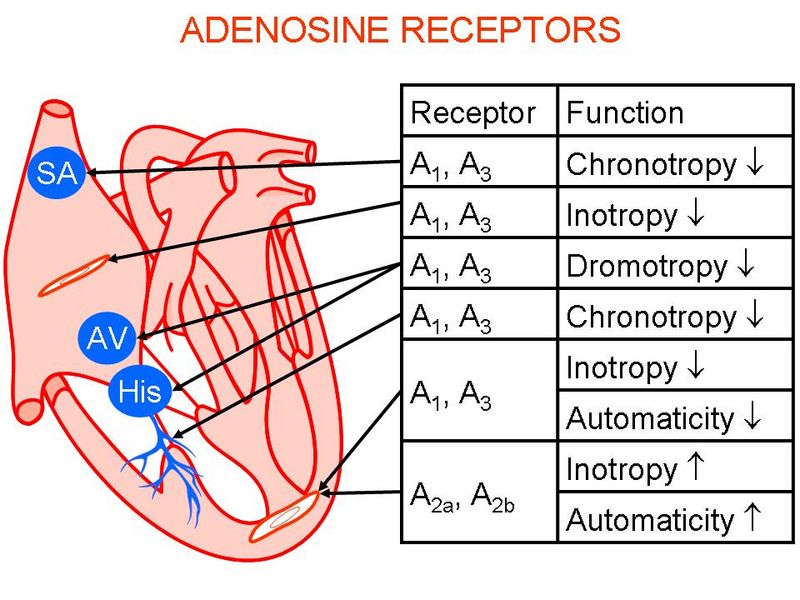
Adenosin wird als Antwort auf ein Missverhältnis zwischen dem Sauerstoffverbrauch und Sauerstoffangebot freigesetzt, z. B. bei Ischämie oder massiver Ausschüttung von Streßhormonen (Katecholaminen). Adenosin wird als protektiver Mediator angesehen und bewirkt eine Normalisierung der energetischen Bilanz. Da Ischämie und exzessive Katecholamin-Stimulation u. a. auch ischämische und dilatative Kardiomyopathien kennzeichnen, ist die pathophysiologische Rolle einer gestörten Adenosin-vermittelten Autoregulation bei bestimmten Formen menschlicher Herzinsuffizienz seit langem vermutet worden. Adenosin-Effekte am Herzen werden durch 3 verschiedene Rezeptor-Subtypen (A1, A2A, A3) vermittelt, die an unterschiedliche G-Proteine koppeln. Unsere Arbeitsgruppe beschäftigt sich seit Jahren mit den Wirkungen von Adenosin und der Bedeutung von G-Proteinen (Boknik et al. Brit J Pharmacol 158:1557-64, 2009) am Herzen. In Zusammenarbeit mit Prof. Dr. Matherne (Charlottesville) haben wir 3 transgene Tierlinien mit unterschiedlich starker A1-AR-Überexpression charakterisiert. Untersuchungen an diesen Tieren haben gezeigt, dass nur chronotrope Effekte von Adenosin durch PTX-sensitive Proteine vermittelt werden (Neumann et al. Brit J Pharmacol 138:209-217, 2003a; 2003b). Die Vorhöfe A3-AR-transgener Mäuse sind stark vergrößert und zeigen eine interstitielle Fibrose. Eine telemetrische EKG-Analyse der A1-AR- und A3-AR-überexprimierenden Tiere belegte eine Bedeutung dieser Rezeptoren für polymorphe atriale Tachykardien (Fabritz et al. Cardiovasc Res 62:500-508, 2004; Kirchhof et al. Am J Physiol Heart 285:H145-H153, 2003). Eine transgene Tierlinie mit herzspezifischer Überexpression des A2A-AR generiert und untersuchen zurzeit die physiologische und pathophysiologische Bedeutung dieses Adenosinrezeptor-Subtyps im Herzen.