







Frequenz und prognostische Bedeutung von ZNS Befall bei Non-Hodgkin-Lymphom- Rezidiven im Kindes- und Jugendalter
Das Non-Hodgkin Lymphom (NHL) stellt die vierthäufigste Tumorerkrankung im Kindes- und Jugendalter dar. Mittels aktueller Therapieprotokolle können in der Erstlinientherapie Überlebensraten von nahezu 90 % erreicht werden. Rezidive hingegen zeigen zumeist Überlebensraten von unter 30 %. Ein relevanter Faktor in Bezug auf Rezidiv- und Überlebensrate stellt der Befall des zentralen Nervensystems (ZNS) dar. Die aktuelle Datenlage der Rezidiverkrankungen und des Stellenwerts des ZNS-Befalls ist, gerade im Hinblick auf die Subentitäten der NHL, begrenzt. Mittels retrospektiver Analyse einer multizentrischen NHL-Rezidiv-Kohorte sollen Rückschlüsse auf Frequenz und prognostische Bedeutung des ZNS-Befalls gelingen.
Aufgrund der Größe der vorhandenen Datenbasis kann die Auswertung nach NHL-Subentitäten unterteilt erfolgen.
Ansprechpartnerin: Anne-Kathrin Garthe


Die Rolle von TP53 in der Pathogenese des pädiatrischen Burkitt Lymphoms
In eigenen Vorarbeiten konnten wir rekurrente TP53 Mutationen bei Patient:innen, die am Burkitt Lymphom erkrankt sind, nachweisen. Interessanterweise waren TP53 Mutationen statistisch signifikant mit einem erhöhten Rückfallrisiko und somit mit einer schlechteren Prognose assoziiert. Ziel des Projektes ist die biologische Bedeutung von TP53 für Pathogenese des pädiatrischen Burkitt Lymphoms auf molekularer Ebene zu analysieren. Dazu wurde ein in-vitro Zellmodell in Burkitt Lymphom Zelllinien erarbeitet, um den Einfluss der verschiedenen TP53 Mutationen vor dem Hintergrund bekannter molekulargenetischer Signalwege zu charakterisieren.
Ansprechpartner: Leon Feldmeyer, Elina Richter

Unterschiede in der Chemosensitivität von Zellen mit p53-Hotspot Mutationen
Protein 53 (p53) dient als einer der wichtigsten Regulatoren bei DNA-Schädigung, dessen Gen in vielen Krebserkrankungen mutiert ist. In diesem Projekt wird das Ansprechen von Burkitt Lymphom Zellen, die die wichtigsten p53-Mutationen (sog. Hotspot Mutationen) ausprägen, auf diverse Chemotherapeutika anhand von Viabilitätsassays untersucht. Als Ziel liegt hierbei die Optimierung der Therapie je nach p53-Mutationsstatus im Vordergrund.
Ansprechpartner*innen: Marc Hotfilder, Claudia Lanvers-Kaminsky, Vanessa Hollfoth

Die Funktion von PCBP1 bei der Lymphompathogenese des Burkitt Lymphoms
In Burkitt Lymphom Patienten wurden wiederholt mutierte Formen des Gens PCBP1 nachgewiesen. Das Ziel des Projektes ist es, ein grundlegendes Verständnis zum Einfluss des Gens auf die Entstehung von Burkitt Lymphomen zu schaffen. Hierzu werden verschiedene verkürzte Varianten von PCBP1 mittels spezieller Viren in Burkitt Zelllinien eingebracht. Wir gehen davon aus, dass die Verkürzung eine ähnliche Wirkung hat wie ein Verlust des Gens. Daher wird in einem weiteren Ansatz parallel daran gearbeitet, das PCBP1 in Burkitt Zellen herunterreguliert wird. Die veränderten Zellen werden anschließend isoliert und im Hinblick auf zelluläre Signalwege, das Zellüberleben, den Zelltod und den Zellzyklus untersucht. Langfristig sollen Teile dieser Arbeit mit genutzt werden, um die zielgerichtete und patientenspezifische Therapie zu verbessern.
Ansprechpartner: Arne Bartels

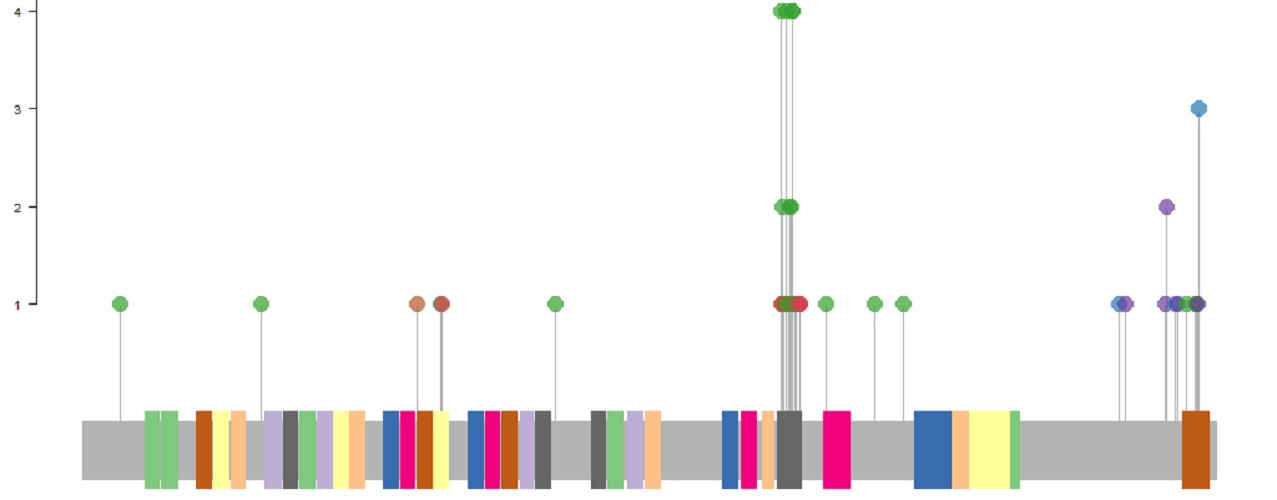
Häufige Mutationen im Transkriptionsfaktor FOXO1 und ihre Bedeutung in Burkitt Lymphom Zellen
Bei der Suche nach relevanten Genen zur Risikostratifizierung zeigte sich bei Vorarbeiten der Arbeitsgruppe, dass Mutationen im FOXO1 Gen in der großen untersuchten Patientenkohorte mit einer geringeren Rückfallhäufigkeit einhergehen.Ziel dieses Projekts ist daher die Beantwortung der Frage warum Mutationen in dem, für einen Transkriptionsfaktor codierenden, Gen einen positiven Einfluss auf den Krankheitsverlauf bei Burkitt Lymphomen haben können.Im Rahmen des Projekts werden Burkitt Lymphom Zelllinien genetisch so verändert, dass Sie die in der Patientenkohorte gefundenen Mutationen tragen, so dass anschließend verschiedene funktionelle Analysen durchgeführt werden können. Es soll die Bedeutung des Transkriptionsfaktors FOXO1 und der Mutationen in FOXO1 für das Überleben der Burkitt Lymphom Zellen und seine Funktion in wichtigen Signalwegen untersucht werden.
Ansprechpartnerin: Lea Kosch

In-vitro-Analyse potentieller genetischer Marker aus pädiatrischen Patienten mit lymphoblastischem Lymphom.
Das lymphoblastische T-Zell-Lymphom, kurz T-LBL, und die akute lymphatischen T-Zell-Leukämie, kurz T-ALL, entsteht durch die maligne Transformation der Vorläuferzellen von T-Lymphozyten. Beide Krebserkrankungen werden in der WHO-Klassifikation der lymphatischen Neoplasien zusammengefasst (T-LBLL).
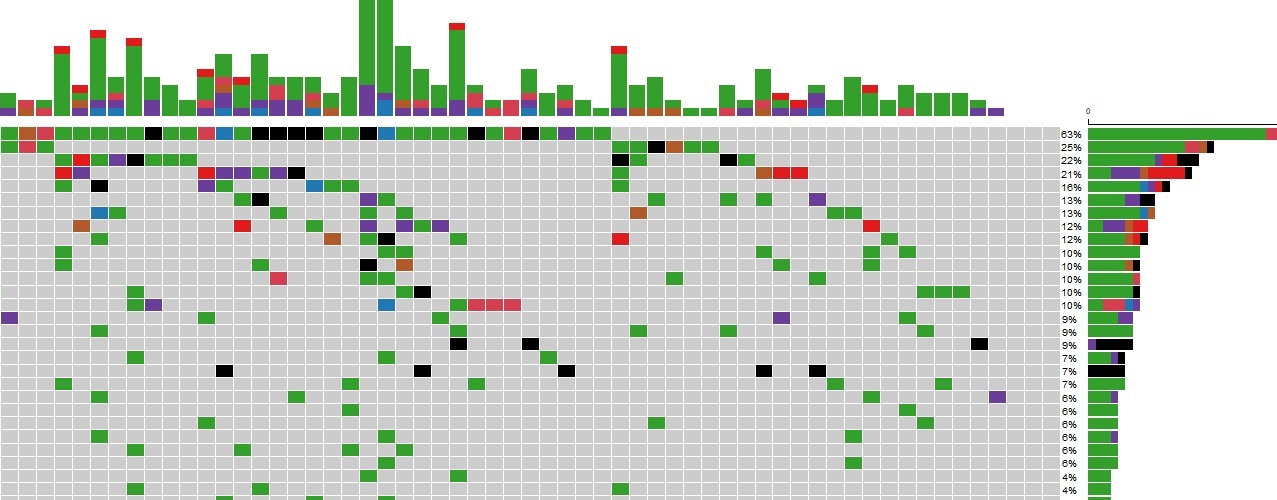
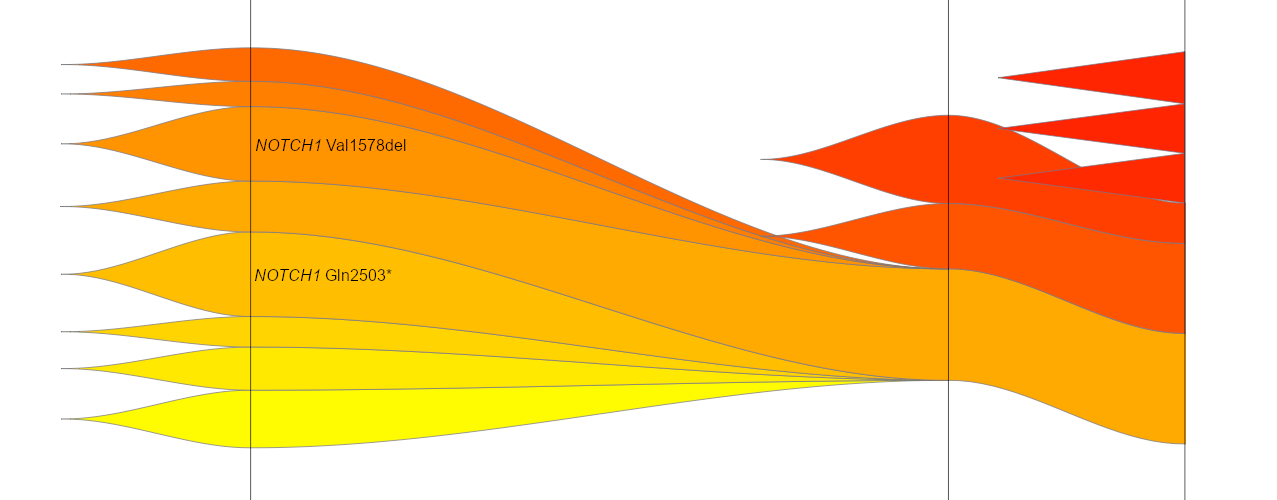
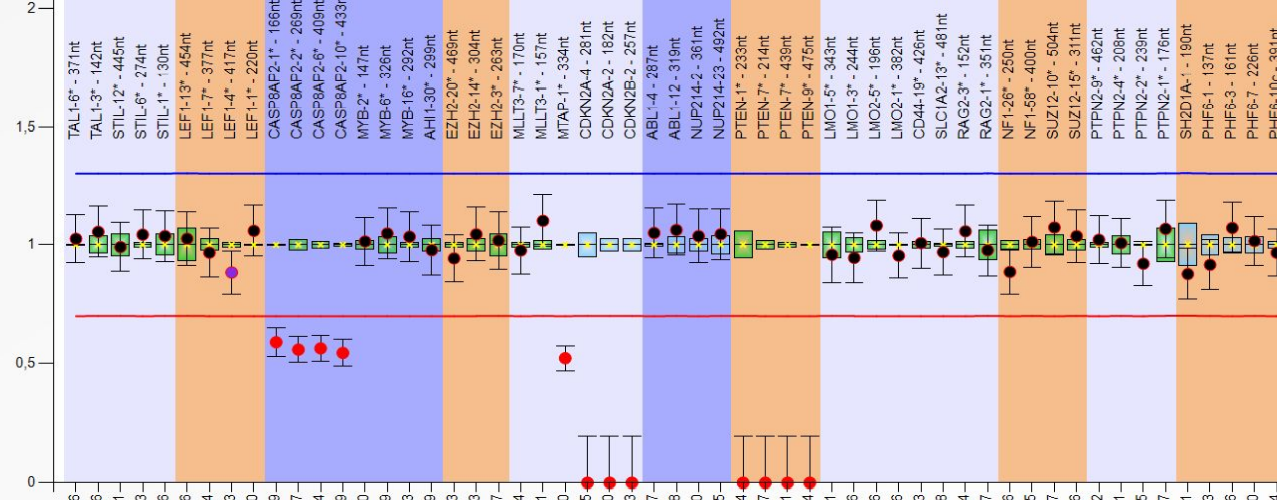
Eine Studie unserer Arbeitsgruppe evaluierte die genomweiten Mutationen in 127 pädiatrischen T-LBL Patienten. Ein neuer potentieller genetischer Marker konnte identifiziert werden: KMT2D-Mutationen wurden vermehrt bei Patienten mit Rückfällen gefunden und könnten somit ein Indikator für eine schlechtere Progression sein. Des Weiteren konnte gezeigt werden, dass NOTCH1 und FBXW7 insgesamt die am häufigsten mutierten Gene in der Patientenkohorte darstellen.
In diesem Masterprojekt werden KMT2D, NOTCH1 und FBXW7 zunächst mit Hilfe der CRISPR-Cas9 Methode in T-ALL und T-LBL Zelllinien individuell ausgeschaltet. Wie sich dieser genetische „Knockout“ auf die Zellproliferation auswirkt, soll anhand verschiedener Methoden untersucht werden. Außerdem werden funktionelle Analysen durchgeführt, um die Rolle der oben genannten Gene in der Entstehung und Entwickelung von T-Zell-Lymphomen und Leukämien besser verstehen zu können. Darüber hinaus, sollen die Interaktionen dieser Indikatoren untersucht und neue Interaktionspartner identifiziert werden.
Auf langfristige Sicht, kann die biologische Analyse der krebsspezifischen Mutationen in diesen Genen zu einem tiefgründigerem Verständnis der Erkrankung und optimierter Indikation führen.
Ansprechpartnerin: Diana Torkin

Lymphoblastische B-Zell Lymphome (pB-LBL): Kann Weniger mehr bedeuten? Retrospektive Analyse unterschiedlicher Therapien für Patienten mit lokalisierten pB-LBL
Precursor B-Zell Lymphome (pB-LBL) machen ca. 20-25% der lymphoblastischen Lymphome im Kindesalter und Jugendalter aus. Sie können lokalisiert (Stadium I-II) oder mit fortgeschrittener Ausbreitung (Stadium III-IV) vorkommen. Die in den letzten Jahrzenten durchgeführte Therapie basiert im Allgemeinen - mit einigen Anpassungen - auf Therapieregimen für akute lymphoblastische Leukämien (ALL).
Weltweit gibt es unterschiedliche Protokolle für die Behandlung dieser seltenen Erkrankung. Einige Protokolle sehen für alle pB-LBL unabhängig vom Stadium der Erkrankung alle Therapieelemente vor. Die Protokolle der NHL-BFM Gruppe sehen hingegen seit mehreren Jahren für Patienten mit lokalisierten Stadien (I und II) die Therapie ohne das Element „Re-Induction“ vor.
Ziel des aktuellen Projektes ist die Analyse dieser Patienten mit limitierten pB-LBL und deren Outcome. In der retrospektiven Analyse der Patienten, die gemäß der Protokolle NHL-BFM 95, EURO-LB02, des LBL Registers und des NHL-BFM Registers 2012 behandelt wurden, werden unter anderem Patientencharakteristika, das Overall Survival (OS), das Event-Free Survival (EFS) und Therapienebenwirkungen analysiert und mit publizierten Daten von Patienten verglichen. Interessant ist hierbei insbesondere der Vergleich der NHL-BFM Daten mit publizierten Daten anderer Studiengruppen, in denen Patienten mit lokalisierter Erkrankung kein reduziertes Therapieprotokoll erhalten.
Letzten Endes wird analysiert, ob man mit weniger Chemotherapie - und damit weniger Toxizität - vergleichbare Therapieerfolge erreichen kann.
Ansprechpartnerin: Laura Arias Padilla

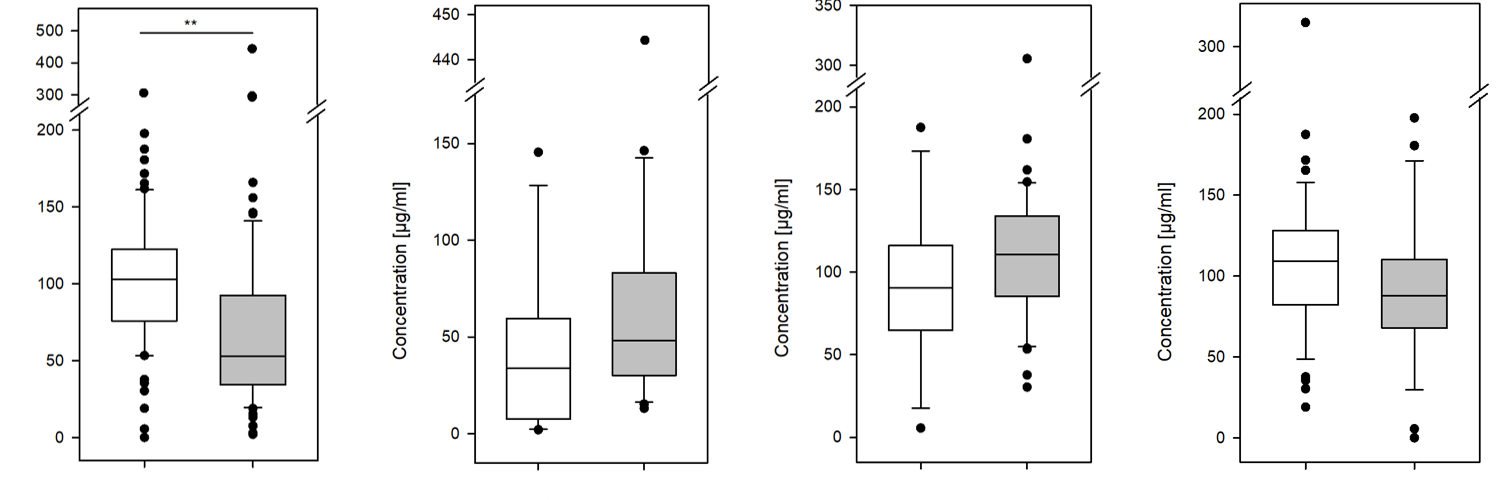
Rituximab-Clearance bei pädiatrischen Patienten mit frühem aggressivem B-Zell-Non-Hodgkin-Lymphom
In den letzten Jahrzehnten konnte die Behandlung pädiatrischer Patienten mit reifem aggressivem B-Zell-Non-Hodgkin-Lymphom (B-NHL) systematisch verbessert werden, so dass die Gesamtüberlebensrate 80-90 % beträgt. Patienten mit refraktären/rezidivierenden Erkrankungen haben jedoch eine schlechte Prognose. Die derzeitigen Chemotherapieschemata in Kombination mit B-Zell-gerichteten Wirkstoffen, wie dem Anti-CD20-Antikörper Rituximab, verbessern die Ergebnisse für Hochrisikopatienten. Es gibt nur wenige Daten zu den einzelnen Parametern, die das Ansprechen auf Rituximab beeinflussen könnten, und zu den Bedingungen, die eine Anpassung der empfohlenen Dosis von 375 mg/qm erfordern könnten. Frühere Daten zeigen eine Korrelation zwischen einer hohen Tumorlast und niedrigen Rituximab-Serumspiegeln sowie niedrigeren Rituximab-Spiegeln bei erwachsenen Männern als bei Frauen.
Um die Wirksamkeit von Rituximab bei Kindern mit B-NHL durch Dosisanpassung zu optimieren, analysieren wir mögliche Parameter, die die individuelle Clearance von Rituximab beeinflussen.
Ansprechpartnerin: Ida Tölle
Folgen Sie auch gerne unserem Twitter-Account um mehr über unseren Laboralltag und Neuigkeiten aus der Studienzentrale zu erfahren!