News
Das aktuelle "Paper of the Month" geht an: Marie Liebmann aus der Klinik für Neurologie mit Institut für Translationale Neurologie
Für den Monat August 2018 geht das "Paper of the Month" der Medizinischen Fakultät der WWU Münster an:
Marie Liebmann aus der Klinik für Neurologie mit Institut für Translationale Neurologie für die Publikation:
Zu Hintergrund, Fragestellung und Bedeutung der Publikation:
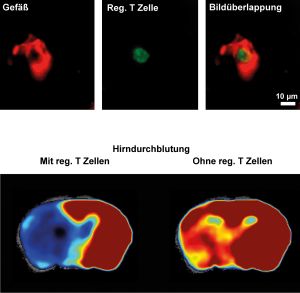
T-Zellen sind für Entzündungsprozesse im zentralen Nervensystem verantwortlich. Um den Energiebedarf für Zellteilung und Effektorfunktion zu decken, müssen aktivierte T-Zellen ihren Stoffwechsel neu programmieren. Dabei können Störungen des Metabolismus auftreten. Sie beeinträchtigen die Zellfunktion so, dass sie autoimmune Prozesse vorantreiben. Ein intrinsischer Faktor, der die metabolische Funktion in T-Zellen reguliert, war bisher unbekannt.
Wir konnten nun zeigen, dass der nukleäre Rezeptor Nur77 die Aktivierung von T-Zellen sowohl im Mausmodell als auch beim Menschen hemmt. Zudem limitiert Nur77 zumindest im Mausmodell auch die Teilung der autoreaktiven Zellen. Dies geschieht, indem der Rezeptor während der Aktivierung der T-Zellen die mitochondriale Atmung und aerobe Glykolyse kontrolliert. Interessanterweise steuert Nur77 im Organismus zudem die Entzündung bei Autoimmunerkrankungen, wie wir in Tiermodellen für Multiple Sklerose, Arthritis und Kontaktdermatitis zeigen konnten.
Damit konnten wir erstmals belegen, dass Nur77 den T-Zell-Metabolismus beeinflusst und so auf die T-Zell-vermittelte Autoimmunität wirkt. Würde Nur77 durch ein Medikament gezielt aktiviert, könnte dies die lokale Aktivierung von autoreaktiven T-Zellen begrenzen. Damit wäre der zentrale Mechanismus vieler Autoimmunkrankheiten gehemmt.
Background and fundamental question of the publication:
Activated T cells depend on the metabolic reprogramming to serve their energy demands during clonal expansion and acquirement of effector functions. Recent data suggest that T cell immunometabolism regulates T cell function and T cell-mediated autoimmunity. However, an intrinsic factor regulating metabolic function in T cells was unknown, yet.
We identify the nuclear receptor Nur77 as a cell intrinsic modulator of human and murine T cell activation. Additionally, it inhibits proliferation in murine T cells. Further, Nur77 restricts T cell immunometabolism, by regulating aerobic glycolysis and oxidative phosphorylation during T cell activation. Pathophysiologically, Nur77 limits inflammation in autoimmune conditions in animal models of CNS autoimmunity, arthritis, and contact dermatitis.
Our data define Nur77 as a key regulator of T cell immunometabolism restricting T cell mediated autoimmunity. Therefore, activation of Nur77 might be a promising approach to limit local activation of autoreactive T cells in autoimmune diseases.
Die bisherigen ausgezeichneten "Papers of the Month" finden Sie HIER.