News
Der Arterienbildung auf der Spur: Forscherteam aus Münster und Gießen weist Zusammenhang mit Notch-Rezeptor nach
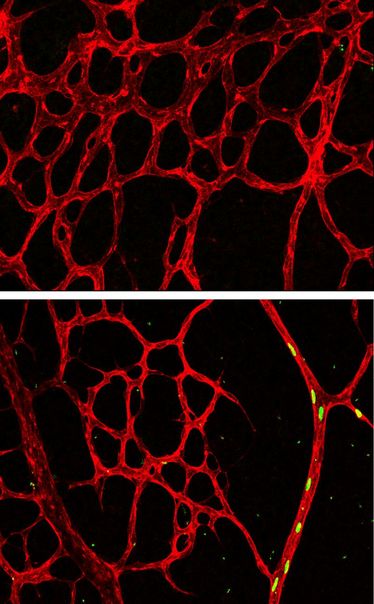
Überexprimierung von aktivem Notch bringt alle markierte Abkömmlinge (grün, Zellkerne) in die Arterien des vaskulären Plexus der Retina (rot; Bild unten; 96 Stunden nach Pulse-Chase-Experiment). In der Expansionszone des peripheren Plexus sind keine markierten Zellen mehr vorhanden (Bild oben; Abb.: MPI Münster / M. E. Pitulescu)
Münster/Gießen (mpi) – Die Arterienbildung ist ein elementares Ereignis – nicht nur in der Entwicklungsphase, sondern auch im Erwachsenenleben. Kardiovaskuläre, lebensbedrohliche Krankheiten könnten mit neuen Therapien überwunden werden, zum Beispiel wenn sich die Bildung neuer Arterien anregen ließe. Über die Mechanismen der Arteriogenese, so der Fachbegriff für die Arterienbildung, ist jedoch nicht viel bekannt. Ein Wissenschaftlerteam um Prof. Ralf Adams vom Max-Planck-Institut für molekulare Biomedizin in Münster hat nun einen eleganten genetischen Ansatz in Mäusen entwickelt, um die molekularen Mechanismen aufzudecken, die das Arterienwachstum koordinieren. Zusammen mit Kollegen von der Universität Gießen fanden die Forscher heraus, dass ein Rezeptor namens Notch in diesem Prozess essentiell ist. Die Erkenntnisse sind in der aktuellen Ausgabe von „Nature Cell Biology“ erschienen.Laut der Publikation bringt hohe Notch-Aktivität sprießende Zellen der vordersten Wachstumsfront dazu, sich in entwickelnde Arterien einzugliedern. Es handelt sich um die erste Studie anhand von Mäusen, die den Beweis für eine direkte Verbindung zwischen angiogener Sprossung und Arterienbildung liefert. Diese Erkenntnisse aus der postnatalen Entwicklung könnten helfen, neue therapeutische Ansätze zu identifizieren, die die Bildung neuer Arterien nach Organverletzungen anregen.Das Blutgefäßsystem bildet ein komplexes Netzwerk von Arterien, Venen und Kapillaren und transportiert Sauerstoff, Nährstoffe, Zellen und Abfallprodukte durch unseren Körper. Demzufolge spielt die Vaskulatur eine sehr wichtige Rolle in nahezu allen Körperfunktionen. Kardiovaskuläre Störungen, wie Herzinfarkt oder Schlaganfall, werden durch funktionsgestörte Arterien verursacht und sind mittlerweile weltweit die häufigste Todesursache. Erkenntnisse über die Bildung und das Wachstum von Arterien unter physiologischen Bedingungen könnten für die Identifikation neuer therapeutischer Ansätze zur Wachstumsstimulierung neuer Arterien unter pathologischen Bedingungen ungemein wichtig sein. Vor allem die Arterienbildung ist wichtig, denn nur dieser Gefäßtyp kann genügend Blut in die beeinträchtigten Gewebe transportieren. Wie das vaskuläre Netzwerk aufgebaut ist, ist noch nicht ausreichend gut erforscht – noch weniger ist bekannt, wie die Arteriogenese in therapeutischen Ansätzen stimuliert werden könnte.Wissenschaftler des Labors von Ralf Adams haben nun die Angiogenese – die Bildung neuer Blutgefäße aus einem bestehenden Kapillarnetzwerk – im Gefäßnetzwerk der Retina von neugeborenen Mäusen untersucht. „Die so genannten Leitzellen tasten im wachsenden Gefäßnetzwerk ihre Umgebung ab und weisen den nachfolgenden Endothelzellen die richtige Richtung“, sagt Dr. Mara Pitulescu, Erstautorin der Studie und Wissenschaftlerin in der Abteilung von Adams.Den Leitzellen folgen Stalk-Zellen (to stalk, engl.: verfolgen), welche einen proliferativeren Charakter haben. Direkt hinter den Leit- und Stalk-Zellen sind die Blutgefäße zunächst in einem unausgereiften Plexus arrangiert, von dem aus Arterien, Venen und die verbindenden Kapillaren gebildet werden. Mittels Signalmolekülen interagieren Endothelzellen in diesem Netzwerk andauernd mit benachbarten Zellen und ihrer Umgebung. Dieses Zusammenspiel basiert auf Rezeptoren, die sich auf der Oberfläche von Endothelzellen befinden und auf Liganden, die an die Rezeptoren binden. Vor allem der Notch-Rezeptor und sein Ligand Dll4 sind, neben anderen Rezeptoren und Liganden, für die Angiogenese wichtig.Pitulescu kombinierte genetische Experimente mit pharmakologischen Methoden. „Dieser Ansatz ermöglichte es uns, zwischen Signalen für Zell-Zell-Interaktionen und der Signalkaskade rein innerhalb der Endothelzellen zu unterscheiden“, erklärt Pitulescu. „Wir beobachteten, dass die Notch-Aktivierung an sich wichtiger ist als die eigentliche Notch-basierte Zell-Zell-Kommunikation. Dies ist eine neue Erkenntnis“, sagt Pitulescu.Lange Zeit wurde bezüglich der Expansion eines Gefäßnetzwerkes angenommen, dass die unterversorgte Umgebung Signale abgibt, denen die Leit- und Stalk-Zellen folgen, während das Gefäßnetzwerkes hinter diesen Zellen in die unterversorgte Richtung mitwächst. Mit dem vaskulären Plexus erweitern sich auch die Arterien. Eine frühere Studie aus dem MPI zeigte an Zebrafischen, dass Arterien hauptsächlich gebildet werden durch Endothelzellen, die aus Venen sprießen und sich dann entgegen der allgemeinen Wachstumsrichtung bewegen.Um die genauen Mechanismen der Arterienbildung in Mäusen zu studieren, verwendete das Team einen genetischen Ansatz in Mäusen, bei dem nur die Leitzellen und deren Abkömmlinge markiert werden und über die Zeit verfolgt werden können. „Erstaunlicherweise zeigte sich, dass die Abkömmlinge der Leitzellen entgegen der allgemeinen Wachstumsrichtung des Plexus migrieren und sich innerhalb einiger Tage in Arterien integrieren“, sagt Pitulescu.Die Wissenschaftler konnten den Notch-Ligand Dll4 in Leitzellen gezielt inaktivieren und beobachten, wie sich das Gefäßnetzwerk ausbreitete. Interessanterweise ist Dll4 nicht erforderlich, um Leitzellen in ihrer Position am Rande des wachsenden Gefäßbettes zu halten. „Vielmehr fanden wir heraus, dass CXCR4, ein für Zellmigration wichtiger Chemokin-Rezeptor, für die Erhaltung der Leitzellen notwendig ist“, sagt Pitulescu. Die Experimente verdeutlichten allerdings die Rolle von Dll4: „Wenn Dll4 nicht vorhanden ist und der Notch-Rezeptor dadurch nicht aktiviert wird, verschlechtert sich die Rückwärts-Migration der Leitzellen“, so Pitulescu.„Dies ist die erste Studie in Mäusen, in der gezeigt wird, dass die direkte Verbindung zwischen Sprossung und Arterienbildung gleichermaßen von Notch reguliert wird“, erläutert Ralf Adams, der auch Professor der Medizinischen Fakultät der Westfälischen Wilhelms-Universität Münster und Mitglied des Exzellenzclusters „Cells in Motion“ ist.„Diese Ergebnisse sind von großer Bedeutung für das Verständnis des arteriellen Wachstums“, sagt Prof. Tilman Borggrefe, der mit seinem Gießener Team die biochemischen Analysen der Studie durchführte. „Dies könnte die Grundlage für einen neuen therapeutischen Ansatz sein, in dem bei Bedarf an Arterienbildung die Angiogenese über Notch kontrolliert werden könnte“, so der Biochemiker.Link zur Publikation